低盐发酵甜瓣子体系中产生物胺的菌株与降解菌株能力研究【上】
甜瓣子发酵将为豆瓣酱提供丰富的游离氨基酸、有机酸、挥发性风味物质及多种发酵微生物,是郫县豆瓣生产的重要阶段之一。目前,甜瓣子多采用高盐度发酵,发酵的盐度通常为12%~17%,成品豆瓣酱的盐度高达16%~20%[1]。研究表明摄入过量的盐分,可能会引起心脑血管、高血压等疾病[2]。目前我国每人每天平均膳食盐摄入量为(14.53±11.04)g[3],远超过世界卫生组织(WHO)推荐摄入量5 g/d。豆瓣酱等高盐调味品为我国膳食盐分摄入的主要来源,低盐化已成为其发展的必然趋势。对甜瓣子发酵低盐化的研究具有重要意义。
低盐发酵甜瓣子因体系盐度较低,其游离氨基酸种类及含量相对较多,且发酵体系pH值相对较低,故极易造成生物胺等有害物质积累[4]。生物胺是氨基酸在氨基酸脱羧酶的作用下脱羧生成的一类碱性次生代谢产物,过量摄入将造成一定的安全风险[5-6]。使用生物技术控制发酵食品中生物胺含量已有较广泛的研究,如Kung等[7]、OH等[8]、Guo等[9]均对发酵食品中降解生物胺微生物进行筛选,并研究相关菌株的降解生物胺能力。然而,针对低盐发酵甜瓣子体系中产生物胺的菌株及降解菌株的研究相对较少。本研究采用荧光检测定性分析和高效液相色谱法定量分析,筛选甜瓣子中产生物胺和降解生物胺的菌株,并进行回接验证,分析含盐量和降胺菌株对甜瓣子产品安全性的影响,以期为低盐甜瓣子生物胺含量的控制提供参考。
1试验材料
1.1试剂与仪器
丹磺酰氯、1,7-二氨基庚烷、脯氨酸、鸟氨酸、精氨酸、赖氨酸、酪氨酸、苯丙氨酸、色氨酸、组氨酸、5-磷酸吡哆醛、硫胺素均为化学纯,上海源叶生物科技集团股份有限公司;腐胺、尸胺、酪胺、苯乙胺、组胺、色胺、精胺、亚精胺均为色谱纯,上海源叶生物科技集团股份有限公司;氯化钠、乙腈、乙醚、七水合硫酸镁、硫酸锰、硫酸亚铁、磷酸氢二钾均为分析纯,成都科隆化工有限公司;Ezup柱式真(细)菌基因组DNA抽提试剂盒,生工生物工程股份有限公司。
126-Ⅱ高效液相色谱,安捷伦科技有限公司;凝胶成像仪,君意电泳有限公司;H2050R-1离心机,长沙高新技术产业开发区湘仪离心机仪器有限公司;DZKW-4恒温水浴锅,北京中兴伟业仪器有限公司;ESJ200-4A型分析天平,沈阳龙腾电子有限公司;SPX-150B-4生化培养箱,上海博讯实业有限公司医疗设备厂;THZ-82水浴恒温振荡器,常州市中贝仪器有限公司;GeneAmpR9700型PCR仪,美国ABI公司。
1.2试验所用培养基
生物胺显色培养基:参考Sara等[10]方法略作修改后配制;以生物胺为唯一氮源培养基(BAs):参考赵佳迪[11]的方法,略作修改后配制。
6%/9%/12%盐度甜瓣子模拟体系(以100 mL计):霉瓣子25 g+盐4.5,9.4,13 g+5-磷酸吡哆醛0.005 g+碳酸钙0.01 g+70 g水,混匀121℃,15 min灭菌。
6%盐度含生物胺的甜瓣子模拟体系(以100 mL计):霉瓣子25 g+盐4.5 g+4 mL生物胺100 mg/L(8种)+5-磷酸吡哆醛0.005 g+碳酸钙0.01 g+70 g水,混匀121℃,15 min灭菌。
2试验方法
2.1甜瓣子中产生物胺菌株筛选及其不同盐度下产胺能力研究
2.1.1产胺菌株筛选称取200 g霉瓣子,加入200 g饮用水,称取16 g食用盐,整个甜瓣子发酵体系的盐度为4%,37℃发酵30 d。称取10 g 4%盐度甜瓣子,用生理盐水逐级稀释。选取适宜梯度的稀释液100μL分别涂布于含有溴甲酚紫的固体显色培养基上,37℃培养12 h。挑取培养后使培养基变紫的菌株至LB培养基上分离、纯化即为初筛菌株。将初筛菌株接种至液体显色培养基进行复筛,以不接种菌株的显色培养基为空白对照。37℃过夜培养,挑选培养后培养液明显变紫的菌株初步判定为产生物胺的菌株。采用生工生物工程股份有限公司基因组DNA提取试剂盒提取DNA后,分别利用PCR扩增16S rDNA、18S rDNA和ITS序列,送至北京擎科新业生物技术有限公司进行测序,通过BLAST比对序列,构建系统发育树。
2.1.2高效液相色谱法测定生物胺含量参考陈功等[12]建立的HPLC测定不同样品生物胺含量的方法,略作修改,洗脱程序如表1所示。
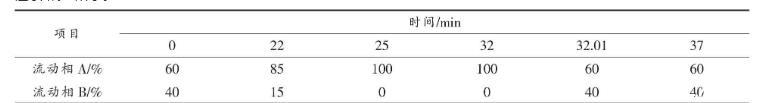
表1生物胺检测的洗脱程序
采用HPLC测定样品生物胺含量,建立标准曲线,根据标准曲线计算试样中生物胺的含量,所得含量明显高于空白组的菌株即确定为产生物胺菌株。
2.1.3高产生物胺菌株回接至不同盐度甜瓣子体系产生物胺能力研究将筛选得到高产生物胺的菌株回接于液体培养基(1 L)中,扩大培养24 h,8 000 r/min,4℃低温离心10 min得到菌体,以108CFU/g回接至不同盐度甜瓣子(6%,9%,12%)模拟体系中;以接种等量无菌水的灭菌甜瓣子模拟体系为空白对照,以该盐度未灭菌甜瓣子接种等量无菌水为正常发酵甜瓣子对照,30℃恒温发酵16 d后,测定甜瓣子中生物胺含量。
2.2生物胺降解菌株筛选及降解能力研究
2.2.1不产生物胺菌株筛选选取46株课题组前期从甜瓣子中筛出的不同菌属菌株为研究对象,分别活化后接种至生物胺液体显色培养基中,以接种等量无菌水为空白对照。恒温培养48 h后,挑选显色培养基不变紫的菌株初步判定为不产生物胺菌株。
2.2.2降解生物胺菌株筛选及其降解能力测定根据生物胺在荧光条件发色,生物胺含量与特定波长下荧光强度呈正相关原理,参考Judite等[13]方法略作调整后,建立荧光定性分析样品中生物胺含量的方法,初步筛选提取液荧光强度弱于空白对照的菌株为可能降解生物胺的菌株。将初筛得到的降解生物胺菌株接种到BAs培养液中,以接种等量无菌水的BAs培养液为空白对照,37℃振荡培养12 h后,观察其菌株生长情况并于620 nm波长下测定其OD值,测定菌株在以生物胺为唯一氮源的培养基中的生长情况。按上述方法对BAs培养液提取衍生后,再次测定荧光强度,选取荧光强度弱于空白对照组的菌株为降解生物胺菌株。高效液相色谱测定降胺菌株培养液中生物胺含量,并用公式(1)计算其生物胺降解率。
式中,X——生物胺降解率(%);C1——空白组中生物胺浓度(mg/kg);C2——接种菌株培养后培养液中生物胺浓度(mg/kg)。
2.2.3降解生物胺菌株回接甜瓣子模拟体系将筛选菌株回接到6%盐度甜瓣子模拟体系中,以接种等量无菌水发酵体系为空白对照,30℃发酵30 d。根据表2甜瓣子感官评价标准对甜瓣子进行感官评分并采用高效液相色谱测定甜瓣子模拟体系中生物胺含量。

表2甜瓣子感官评价标准[14]
2.3数据分析
以上数据均做3个重复样品,采用Excel、Origin、MEGA7对数据统计处理及作图。
相关新闻推荐
1、冷鲜猪肉中热杀索丝菌生长动力学模型和货架期预测模型构建——结果与分析、结论
2、梅花鹿源A型产气荚膜梭菌的分离鉴定、测序、毒素型、生化、耐药性分析(二)
3、一般门诊男女泌尿生殖系统沙眼衣原体检出率及药敏试验结果分析
