罗尔阿太菌生长曲线、原生质体制备条件及融合技术(二)
1.4原生质体制备及条件
1.4.1原生质体制备与再生取培养55 h的种子发酵液9 mL,取1 mL涂布于PDA培养基上,29℃条件下培养。其余8 mL菌悬液中加入1 mL 5.56 mmol·L——1的β-巯基乙醇,静置30 min。6500 r·min——1离心15 min,弃上清液留菌丝体,渗透压稳定剂洗涤2次。加入1 mL的酶液,32℃条件下60 r·min——1振荡酶解,渗透压稳定剂洗涤2次,去酶液,6500 r·min——1离心15 min,弃上清液留原生质体。原生质体保存于渗透压稳定剂中,取1 mL涂布于低渗培养基,1 mL涂布于双层再生培养基上,29℃条件下培养。按公式计算原生质体的形成率和再生率。
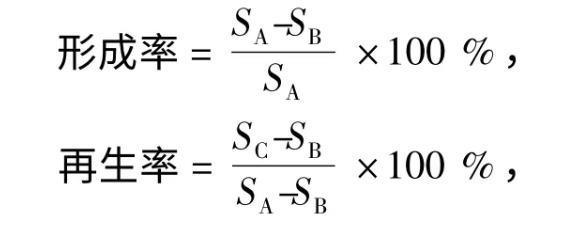
式中,SA、SB、SC分别为PDA培养基、低渗培养基、双层再生培养基上的菌落面积(cm2)。
1.4.2原生质体制备条件的选择
破壁酶:选用培养55 h的菌悬液,0.4 mol·L——1的KCl作为高渗稳定剂,3.1 mg·mL——1的酶,32℃酶解55 min,分别选择7组酶进行单因素试验。其中,第1组为纤维素酶(pH 5.0),第2组为蜗牛酶(pH 5.8),第3组为溶壁酶(pH 5.4),第4组为复合酶(纤维素酶φ为2%、蜗牛酶φ为4%、溶壁酶φ为2%,pH 5.5),第5组为复合酶(纤维素酶φ为2%、蜗牛酶φ为2%、溶壁酶φ为4%,pH 5.5),第6组为复合酶(纤维素酶φ为4%、蜗牛酶φ为2%、溶壁酶φ为2%,pH 5.5),第7组为复合酶(纤维素酶φ为2%、蜗牛酶φ为2%、溶壁酶φ为2%,pH 5.5)。
酶浓度:选用培养55 h的菌悬液,0.4 mol·L——1的KCl作为高渗稳定剂,分别选择1.3、2.2、3.1、4.0、4.9和5.8 mg·mL——1的第5组复合酶,32℃条件下酶解55 min,进行单因素试验。
酶解温度:选用培养55 h的菌悬液,0.4 mol·L——1的KCl作为高渗稳定剂,3.1 mg·mL——1的第5组复合酶酶解55 min。分别选择26、28、30、32、34和36℃进行单因素试验。
酶解时间:选用培养55 h的菌悬液,0.4 mol·L——1的KCl作为高渗稳定剂,3.1 mg·mL——1的第5组复合酶32℃条件下分别振荡酶解25、35、45、55、65、75和85 min进行单因素试验。
pH:选用培养55 h的菌悬液,0.4 mol·L——1的KCl作为高渗稳定剂,3.1 mg·mL——1的复合酶(纤维素酶φ为2%、蜗牛酶φ为2%、溶壁酶φ为4%)32℃酶解55 min。pH分别选择3.5、4.5、5.5、6.5、7.5、8.5进行单因素试验。
渗透压稳定剂:选用培养55 h的菌悬液,3.1 mg·mL——1的第5组复合酶,32℃酶解55 min。分别选择0.4 mol·L——1的NaCl、蔗糖、KCl、MgSO4进行单因素试验。
在上述单因素试验基础上,以原生质体形成率和再生率为指标,通过正交试验L16(45)(表1)确定原生质体制备的最佳条件。
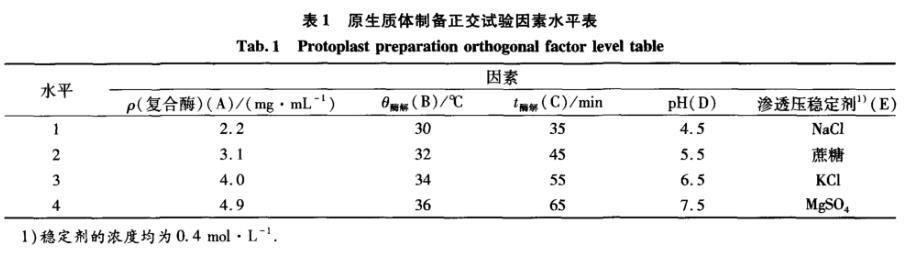
表1原生质体制备正交试验因素水平表
1.5原生质体紫外灭活和热灭活
将制备好的Ar-1和Ar-2原生质体悬浮液等体积混合,均分为2份,记为Ⅰ和Ⅱ,Ⅰ用于紫外灭活,Ⅱ用于热灭活。
从Ⅰ中取1 mL涂布于双层再生培养基上,29℃条件下培养。余下部分均分为6组,分别在紫外光下灭活1、3、5、7、9和11 min,各取1 mL涂布于再生双层培养基上,29℃避光培养。
从Ⅱ中取1 mL涂布于双层再生培养基上,29℃条件下培养。余下部分均分为21组,分别于45、55和65℃的恒温水浴锅中保温15、25、35、45、55、65和75 min,各取1 mL涂布于再生双层培养基上,29℃条件下培养。按公式计算原生质体灭活率。
灭活率=(Su-St)/Su*100%
式中,SU表示未经紫外和热灭活的再生菌落面积(cm2),ST表示经紫外和热灭活后的再生菌落面积(cm2)。
1.6原生质体融合
1.6.1原生质体融合分别取“1.5”中不同方法灭活的原生质体悬液,等体积混合均匀,6500 r·min——1离心15 min,弃上清液留原生质体。加入PEG6000促融,30℃水浴处理,不同时间段取出。0.4 mol·L——1的KCl洗涤2次,去除PEG6000,重悬于KCl中,取1 mL涂布于再生双层培养基上,29℃培养,按公式计算原生质体的融合率。
融合率=Sr/Su*100%
式中,SR、SU分别表示融合子菌落面积和未灭活的原生质体再生菌落面积(cm2)。
1.6.2原生质体融合条件的选择PEG6000浓度:向2 mL灭活后的原生质体悬液中分别加入4 mL 0.25、0.30、0.35、0.40、0.45和0.50 g·mL——1的PEG6000在30℃条件下融合25 min。
融合时间:向2 mL灭活后的原生质体悬液中分别加入4 mL 0.4 g·mL——1的PEG6000,在30℃条件下分别融合10、15、20、25、30和35 min。
融合温度:向2 mL灭活后的原生质体悬液中分别加入4 mL 0.4 g·mL——1的PEG6000分别在26、28、30、32、34和36℃条件下融合25 min。
1.7融合子的筛选
再生培养基上长出融合子后,挑选长势良好的融合子传代5次,划线法接种于PDA斜面培养基上,29℃条件下培养。转接入种子培养基中,29℃、200 r·min——1空气浴振荡培养。再转接入发酵培养基中,接种量为7%,29℃、200 r·min——1空气浴振荡培养5.5 d.测定发酵液中多糖及草酸产量,最终筛选出1株多糖产量高且草酸产量低的融合菌株。多糖含量的测定采用蒽酮硫酸法,草酸含量的测定采用分光光度法。
