鸭瘟病毒基因缺失株rDEV-ΔVP26生长曲线、蚀斑面积及免疫原性分析(三)
2.3重组病毒的一步生长曲线
测定重组病毒rDEV-ΔVP26和亲本毒株rDEV-EF1在CEFs上的一步生长曲线并进行比较,如图4所示,rDEV-ΔVP26株和rDEV-EF1株具有相似的增殖趋势。rDEV-ΔVP26株的滴度在接种CEFs后稳步增加,到84 h时达到峰值,病毒滴度为105.36 TCID50·0.1 mL-1。rDEV-EF1稳步增加到60 h达到峰值,病毒滴度为105.6 TCID50·0.1 mL-1。在此期间rDEV-ΔVP26滴度较亲本毒株rDEV-EF1有所降低,说明UL35基因缺失会轻微影响病毒增殖,并降低病毒滴度。
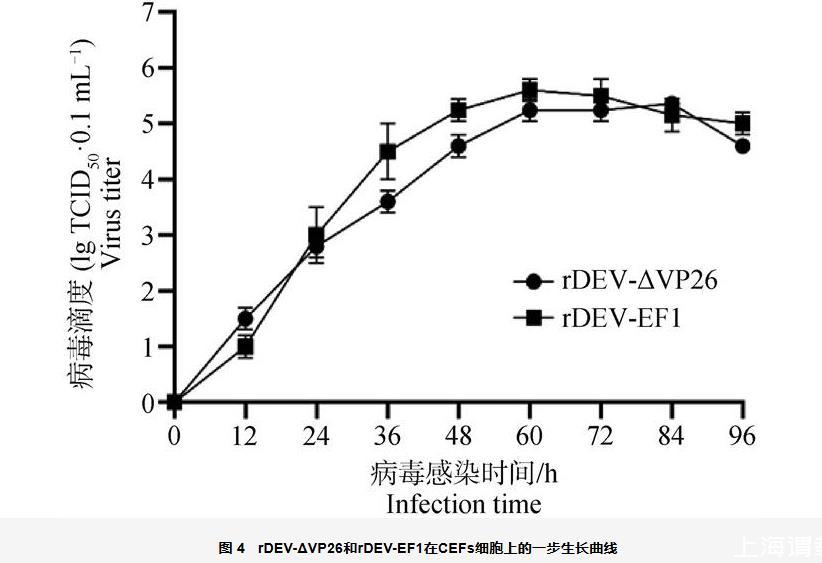
图4 rDEV-ΔVP26和rDEV-EF1在CEFs细胞上的一步生长曲线
2.4重组病毒蚀斑面积测定
rDEV-EF1和rDEV-ΔVP26感染细胞48 h,各拍摄病毒蚀斑照片100个,并用ImageJ软件测量各个蚀斑面积并计算平均值。发现rDEV-ΔVP26蚀斑面积较rDEV-EF1减少10.60%(P<0.05)(图5)。
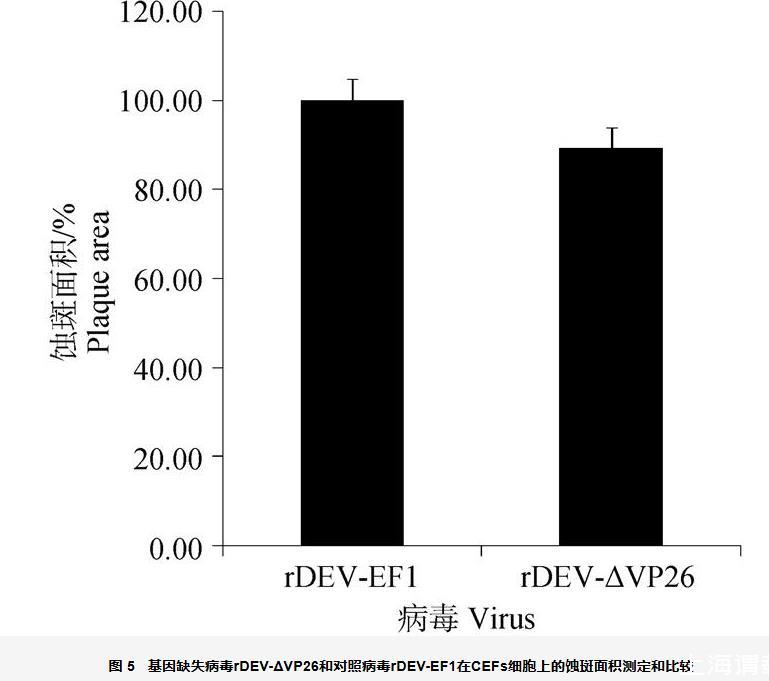
图5基因缺失病毒rDEV-ΔVP26和对照病毒rDEV-EF1在CEFs细胞上的蚀斑面积测定和比较
2.5 UL35基因缺失病毒的安全性分析
各组免疫后观察2周,发现各剂量的rDEV-ΔVP26组、rDEV-EF1组和DMEM对照组鸭子精神状态良好,均未出现死亡(表2)。
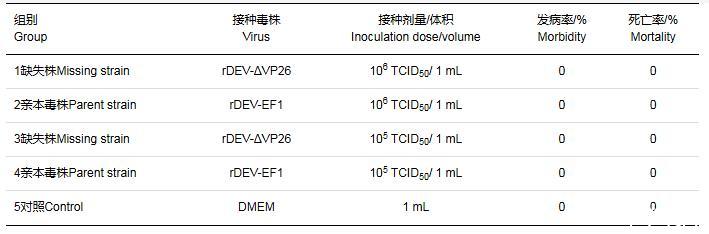
表2不同剂量rDEV-ΔVP26免疫鸭对鸭子的安全性试验
2.6 UL35基因缺失病毒的免疫原性分析
在免疫rDEV-ΔVP26或rDEV-EF1 14 d后,用同一剂量的DEV CHv株(100 DLD50)进行攻毒,于2周内观察鸭的发病和死亡情况(图6),发现1×104 TCID50的rDEV-ΔVP26免疫组鸭在攻毒5 d后死亡2只,保护率为75%;1×104 TCID50 rDEV-EF1免疫组鸭在攻毒后5 d死亡1只,保护率为87.5%;1×105 TCID50 rDEV-ΔVP26免疫组鸭和1×105 TCID50 rDEV-EF1免疫组鸭无死亡,保护率为100%。DMEM对照组鸭在攻毒后全部发病并死亡,其中第4天死亡1只,第5天死亡6只,第6天死亡1只。正常对照组试验期间全部存活。对各组鸭的存活率进行统计,注射1×105 TCID50 rDEV-ΔVP26组的存活率与亲本对照组rDEV-EF1保护率相同,均为100%。注射1×104 TCID50 rDEV-ΔVP26组的存活率较亲本对照组rDEV-EF1下降12.5%。该研究结果表明,1×105 TCID50的rDEV-ΔVP26免疫麻鸭后,诱导针对DEV强毒株的免疫保护能力与亲本疫苗株相同。
分别用两种剂量(1×104 TCID50和1×105 TCID50)的rDEV-ΔVP26和对照毒株rDEV-EF1免疫鸭后14 d,用DEV强毒株对免疫鸭进行攻毒,统计鸭的存活率。
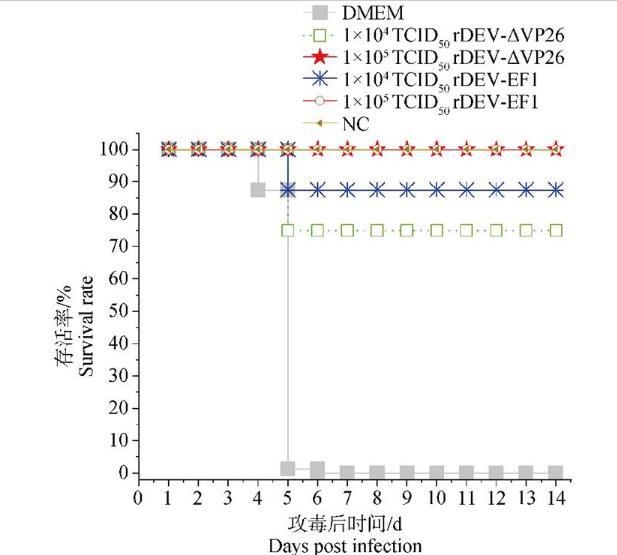
图6 rDEV-ΔVP26的免疫保护效果
3讨论
鸭瘟是鸭、鹅和其他雁形目禽类的一种急性、热性、败血性疾病。尚无有效的治疗药物,预防接种仍是防控DEV的主要手段。目前,市场上在售疫苗主要以传统疫苗为主,包括灭活疫苗和弱毒疫苗。灭活疫苗成本高、副反应大,也存在灭活不彻底的风险。DEV鸡胚化减毒活疫苗免疫效果好,但是存在毒力返强和隐性带毒等安全隐患。通过疫苗免疫曾控制了DEV的流行,但目前鸭瘟疫情存在死灰复燃之势。近年来,在山东、江西、河北、江苏、河南、安徽、湖北、福建、广西等地蛋鸭、樱桃谷肉鸭、种鸭、番鸭均出现了新型鸭瘟疫情。虽然新型鸭瘟与传统鸭瘟,在鸭的解剖病变与症状方面存在许多相同之处,但是新型鸭瘟传播速度更快、致死率和死亡率更高,且在雏鸭开始发病。因此,亟需一种更安全有效的新型疫苗,既可进行有效防控,又能从病毒基因组水平与抗体水平将疫苗接种与野毒感染鸭区分,从而开展鉴别诊断,对感染鸭及时有效地进行淘汰。
目前,通过检测DEV UL2、LORF5基因能区分免疫的疫苗株和强毒株,但疫苗免疫后抗体水平的监测缺乏有效的评估手段。而且研究表明由鸡胚传代致弱的DEV疫苗株对鸡群是致死的,因此接种DEV疫苗株的鸭群对于混养的鸡群来说存在安全隐患。DEV VP26被证实与病毒致病性相关,UL35基因缺失株相比于DEV疫苗株理论上安全性更好。
在α-疱疹病毒中,比较成功的案例是伪狂犬病病毒(pseudorabies virus,PRV)基因缺失疫苗,缺失的靶标集中于非必需的毒力相关基因,如tk、US8(gE)、US7(gI)、US4(gG)等,PRV TK-/gE-弱毒疫苗,很早以前已经广泛应用于美国、欧盟等启动PRV根除计划的国家;PRV gE-/gI-弱毒疫苗,由中国农业科学院哈尔滨兽医研究所引进、国内推广应用多年、安全记录良好;由四川农业大学郭万柱等研发的PRV TK-/gE-/gI-三基因缺失病毒和由华中农业大学陈焕春团队研发的PRV TK-/gG-获得新兽药证书。这些成功的案例给人们研发鸭瘟病毒基因缺失疫苗提供了借鉴。迄今为止,多株鸭瘟病毒基因缺失株已被构建成功,并对其免疫保护能力进行了评估,如鸭瘟病毒ICP27、UL47、US3、UL44(gC)/gE、UL44、US10基因缺失株,都取得了不错的效果,但还没到应用的阶段。
本研究首次将目标瞄准衣壳蛋白,尝试研究最小衣壳蛋白缺失对病毒的影响,发现DEV UL35缺失对其病毒疫苗株安全性没有影响,但病毒传播能力和滴度都有轻微的降低,低剂量(1×104 TCID50)rDEV-ΔVP26的免疫保护能力较对照组有所下降,但高剂量(1×105 TCID50)组无差别,这个剂量与市售的一羽份鸭瘟活疫苗剂量(107.7copies·只-1,即105 TCID50)相当。对于rDEV-ΔVP26作为鉴别诊断基因缺失疫苗的可行性,笔者进行了初步评估,后续还需要开展更多的研究,如病毒接种最低剂量、接种途径、对鸡群的安全性、配套的基于VP26蛋白的间接ELISA检测技术等。
4结论
本研究在鸭瘟病毒疫苗株感染性克隆的基础上,构建了UL35基因缺失的病毒株rDEV-ΔVP26。高剂量rDEV-ΔVP26接种鸭体安全性良好,且1×105 TCID50滴度的rDEV-ΔVP26免疫组在强毒攻击下的保护率与相同剂量的rDEV-EF1对照组一致。该研究为研发用于区分疫苗免疫和野毒感染的DEV鉴别诊断疫苗奠定了基础。
相关新闻推荐
2、肌苷对酸土脂环酸芽孢杆菌的生长抑制效果、对橙汁品质影响——摘要、材料与方法
3、微量量热法研究金银花与灰毡毛忍冬对志贺痢疾杆菌生长代谢的影响(二)
