低温对湿地填料内微生物生长分布及处理效能的影响研究
摘要:针对人工湿地低温运行效率低、填料层内部结构对微生物生长分布影响不明确等问题,采用最大或然数(MPN)法对典型人工湿地正反级配试验柱中氨化细菌、硝化细菌及反硝化细菌生长分布情况及对污染物去除效果进行检测分析,研究环境温度及湿地填料级配设置对微生物生长的影响。结果表明,低温环境对湿地微生物生长均产生抑制,环境温度为15℃的试验柱各项污染物去除率均高于环境温度为5℃的试验柱,在相同环境温度下,反级配试验柱污染物去除效率优于正级配试验柱。反级配试验柱表层较大孔隙率使得氧气更易进入填料层,因此上层填料中氨化细菌、硝化细菌数均高于同温度下正级配试验柱,而反硝化细菌数量则呈现相反的规律。污染物去除效率受环境温度和反硝化底物浓度共同影响,本研究中环境温度为15℃的反级配试验柱对污染物的去除效率最优,其对COD、氨氮、TN污染物平均去除率可分别为46.18%、45.50%、45.28%。
人工湿地技术因工程建设费用低、处理效果好,被广泛应用于污水处理厂尾水深度处理、河道净化及生态恢复等领域[1-2]。但在实际应用过程中,人工湿地技术仍存在单位面积处理能力较低、冬季受低温抑制影响较大等问题[3-4]。针对上述问题,新型湿地基质填料和低温微生物菌剂的研发成为该领域的研究重点和难点[5-6]。王荣等[7]对正反级配填料垂直潜流湿地处理效能进行对比分析;王国强等[8]开发了以煤矸石、沸石为主材的人工湿地复合反级配填料方案;谭月臣等[9]采用保温覆盖、薄膜覆盖、温室大棚等方式提高低温环境下人工湿地运行温度;魏清娟[10]通过对填料层中耐低温微生物的筛选、复配,开发新型耐低温复合菌剂以提高低温环境下人工湿地内微生物活性。然而由于人工湿地各处理单元内铺设有大量硬质复合填料,对其进行监测和取样相对困难,使得目前人工湿地技术的研究多以进出水水质优劣为唯一评价标准,对填料层内部微生物相分布及变化的研究相对较少。有研究表明,人工湿地反级配填料方案可在保证污染物去除效率的同时降低人工湿地填料堵塞速率,具有较好的应用前景。但反级配填料表层较大的孔隙率是否会在低温环境下导致更多冷空气进入填料层内部,进一步抑制填料层内微生物活性,此类研究鲜见报道。
本研究选取典型人工湿地正反级配方案,通过对常温和低温环境下微生物种类、分布及对各类污染物去除效果进行监测,从而研究低温对人工湿地正反级配填料内微生物的影响,为人工湿地填料优化技术的研发提供基础支持。
1材料与方法
1.1试验装置
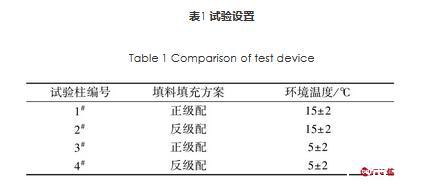
试验装置为4根直径250 mm,高100 cm的有机玻璃柱(见图1),沿有机玻璃柱体垂直方向表层、中层、底层3个位置设置内螺纹阀形取样口,以便于在试验过程中对不同填料层断面微生物取样分析。将2根有机玻璃柱采用传统正级配填料方案进行填充,自柱底至上依次铺设粒径8~10 mm圆形卵石30 cm,粒径5~8 mm砾石30 cm,粒径3~5 mm细砂30 cm。另外两个有机玻璃柱采用反级配填料方案进行填充,自柱底至上依次铺设粒径3~5 mm煤矸石30 cm,粒径5~8 mm无烟煤30 cm,粒径8~10 mm沸石30 cm。试验于冬季进行,将1根正级配柱和1根反级配柱安装于有供暖的实验室内,控制试验期间实验室内环境温度为(15±2)℃;将另1根正级配柱和1根反级配填料装置安装于可调节温度的低温实验室内,控制试验期间低温实验室内环境温度为(5±2)℃。4根试验柱的填料级配、试验温度设置见表1。
表1试验设置
Table 1 Comparison of test device
1.2试验水质
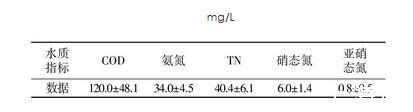
试验进水为稀释后的校园生活污水,进水水质如表2所示。
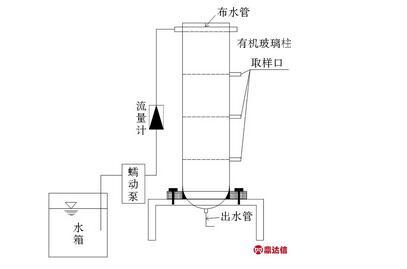
图1试验装置
Fig.1 Flow chart of the device
表2进水水质
Table 2 Influent water quality
mg/L
1.3运行参数
试验采用连续进水方式,水力负荷约为0.35 m3/(m2·d),试验时间为2016年12月至2017年1月。
1.4主要检测指标及方法
试验期间,分别检测4根试验柱出水COD、氨氮、TN指标及柱内表层、中层和底层填料内氨化细菌、硝化细菌和反硝化细菌数量。其中COD采用重铬酸钾法测定;氨氮采用钠氏试剂分光光度法测定;TN采用碱性过硫酸钾消解紫外分光光度法测定。柱内氨化细菌、硝化细菌、反硝化细菌数量采用最大或然数(MPN)法进行检测,具体检测方法如下[11]:分别从各试验柱表层、中层和底层采集人工湿地填料样本,将各填料样本置于三角瓶内加蒸馏水浸泡,于摇床上振荡30 min制成均匀悬浊液,采用10倍梯度稀释法将悬浊液稀释至不同梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8)。每个稀释度接种5管,另取一管接种1 mL无菌水作为对照,于25~30℃恒温培养箱中培养。氨化细菌测定:取培养3、5 d的培养液观察其浑浊度,取5滴培养7 d的培养液于比色板上,加纳氏试剂溶液两滴,产生棕褐色则表示产生氨,说明氨化细菌存在;硝化细菌测定:取培养14 d的培养液5滴于白瓷比色板上,加入格里斯试剂Ⅰ和Ⅱ各两滴,如不呈红色表示亚硝酸已完全消失,此时,取培养液5滴于白瓷比色板上,加入二苯胺试剂2滴,如呈蓝色则表示亚硝酸已经完全被氧化为硝酸,说明硝酸菌的存在,记录每个稀释度呈阳性培养管的数目;反硝化细菌测定:取培养14 d的培养液置于杜氏发酵管中检查是否有气泡出现,用纳氏试剂检查是否有氨氮产生,用二苯胺试剂检查硝酸盐,判断反硝化作用进行的情况。
通过分别统计氨化细菌、硝化细菌、反硝化细菌相邻3组稀释度下阳性培养管数量,查询MPN数值表确定上述菌群的统计数量。
2结果与讨论
采用MPN法分别对1#、2#、3#、4#试验柱内填料表层、中层和底层3处氨化细菌、硝化细菌和反硝化细菌数量及COD、氨氮、总氮等污染物去除效果进行检测分析。研究低温环境下上述各类微生物在湿地填料层间的分布及其对污染物去除效果的影响。
2.1氨化细菌分布情况
1#~4#试验柱填料层不同位置处氨化细菌数量统计见表3。
表3试验柱内各填料层氨化细菌数量统计
Table 3 Quantitative statistics of ammonification bacteria in each layer of column packing layer
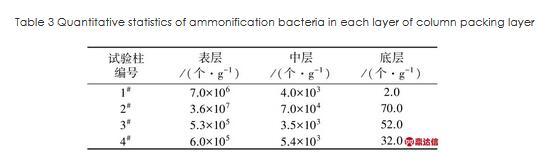
由表3可见,各试验柱内氨化细菌数均随填料层深度增加而减少,环境温度及填料级配均会对试验柱氨化细菌数量产生影响。2#试验柱各层氨化细菌数均为最高,其表层填料中氨化细菌数量达3.6×107个/g,是相同试验温度下1#试验柱表层氨氮细菌数量(7.0×106个/g)的5.14倍,是低温环境下3#、4#试验柱表层氨化细菌数量的68、60倍。各试验柱中层填料间氨化细菌数量明显少于表层,2#试验柱中层氨化细菌数量达7.0×104个/g,明显高于其他3组试验柱,1#、3#、4#试验柱中层填料间氨化细菌数量差异较小;各试验柱底层填料间氨化细菌数量差异较小。综上可知,环境温度为15℃时,由于反级配填料表层较高的孔隙率,大气中氧气易于进入填料层内部,使得试验柱上层区域内氨化细菌数量显著增加。但当环境温度低至5℃时,正反级配试验柱(3#、4#)内表层、中部和底层的氨化细菌数量差异较小,说明相较于湿地填料层间的溶解氧浓度影响,低温对氨化细菌增长有着更明显的抑制作用。
对4组试验柱的COD去除效果进行对比分析,结果见图2。由图2可见,各试验柱对COD的去除效率由高至低排序为2#>1#>4#>3#,其COD平均去除率分别为46.18%、44.58%、40.91%、40.13%。环境温度为15℃时,2#试验柱对COD去除效率高于1#试验柱,在环境温度为5℃时,4#试验柱对COD的去除效率略优于3#试验柱,但差异较小,COD去除效果与试验柱内氨化细菌数量监测结果总体一致。
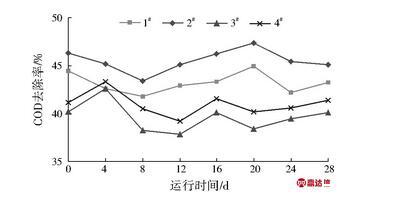
图2各试验柱对COD的去除效果
Fig.2 The COD removal efficiency of different columns
2.2硝化细菌分布情况
1#~4#试验柱填料层不同位置处硝化细菌数量统计见表4。
表4试验柱内各填料层硝化细菌数量统计
Table 4 Quantitative statistics of nitrifying bacteria in each layer of column packing layer

由表4可见,4组试验柱内硝化细菌数自表层至底层呈现逐步递减的趋势,其中表层硝化细菌量由多至少排序依次均为4#>2#>1#>3#,中层硝化细菌量由多至少排序依次均为4#>3#>2#>1#,其中4#试验柱表层硝化细菌数量最多,为7.0×105个/g,是同样温度下3#试验柱表层硝化细菌数量的30.4倍,是1#、2#试验柱表层硝化细菌数量的2.0、1.4倍。3#、4#试验柱中层填料中硝化细菌数量高于1#、2#试验柱,可能是在5℃下低温导致湿地填料表层和中层氨化细菌等好氧菌生长受抑制,使其对填料层间氧气的消耗量降低,进而为同样消耗填料层间氧气并与其生长呈竞争关系的硝化细菌增长提供了空间和便利条件。而4组试验柱底层填料硝化细菌数量基本相同且数量较少,说明此区域多处于缺氧环境,硝化细菌生长困难。由于反级配试验柱填料表层有更高的孔隙率,空气更易于进入湿地填料层内部,为硝化细菌生产和硝化反应提供有利条件,故在相同温度下反级配试验柱硝化细菌数均高于同条件下的正级配试验柱。
对各试验柱氨氮去除效率进行分析,结果见图3。由图3可见,4组试验柱对氨氮去除效率由高至低依次为2#>1#>4#>3#,其氨氮平均去除率分别为45.50%、43.16%、40.98%、39.60%,环境温度为15℃的1#、2#试验柱对氨氮去除效果高于环境温度为5℃的3#、4#试验柱。在相同环境温度下,反级配试验柱对氨氮去除效率高于正级配试验柱。结合表4可知,虽然3#、4#试验柱的硝化细菌数量均多于1#、2#试验柱,但低温环境抑制了硝化细菌的活性,影响其硝化效率,同时低温条件下氨化细菌数量减少使得进水中有机氮氨化效率降低,减少了硝化反应所需氨氮底物浓度,亦是造成3#、4#试验柱硝化细菌数量高而硝化效果却低于1#、2#试验柱的原因之一。
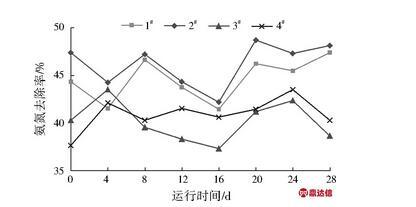
图3各试验柱对氨氮的去除效果
Fig.3 The ammonia removal efficiency of different columns
2.3反硝化细菌分布情况
1#~4#试验柱填料层不同位置处反硝化细菌数量统计见表5。
表5试验柱内各填料层反硝化细菌数量统计
Table 5 Quantitative statistics of denitrifying bacteria in each layer of column packing layer
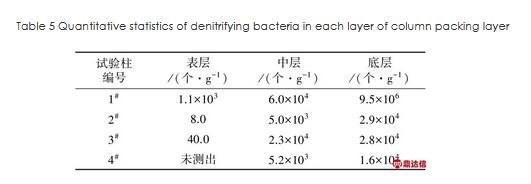
由表5可见,受溶解氧和温度影响,各试验柱中反硝化细菌数量沿表层至底层均呈现逐步增加的趋势。1#试验柱表层反硝化细菌数量为1.1×103个/g,其余3组试验柱表层反硝化细菌数量均大幅减少;4组试验柱的中层反硝化细菌数量由高至低分别为1#>3#>4#>2#,底层反硝化细菌数由高至低依次为1#>2#>3#>4#。1#试验柱各层反硝化细菌数量均明显高于其他3组试验柱,这是因为较高环境温度下,表层异养菌和硝化菌对填料层间氧气的消耗、正级配填料自身相对较低的大气复氧传导能力等,使适宜缺氧环境的反硝化细菌在1#试验柱内大量生长。由于空气易于通过反级配填料表层和中层区域,使反级配填料上中层溶解氧浓度较高,故本试验期间2#、4#反级配试验柱内反硝化细菌数量均少于正级配试验柱。2#、4#试验柱中各层反硝化细菌数基本相同,2#试验柱底层反硝化细菌数略高于4#试验柱,说明环境温度的变化对反级配填料中反硝化细菌的生长影响较小。与1#试验柱相比,3#试验柱各层填料间反硝化细菌数量下降明显,且反硝化细菌随填料深度增加而增长的递增趋势消失,中层、底层反硝化细菌数量基本相同,说明低温对正级配填料中反硝化细菌生长产生明显的抑制作用。综上可知,正级配填料方案可为反硝化细菌的生长提供更好的生存环境,反级配填料表层较大的孔隙率不仅使填料层间形成好氧区影响反硝化细菌的生长,而且使得低温空气进入填料层内部,强化了填料层内部热量的流失,进一步降低了填料层内部区域温度,抑制反硝化细菌生长。
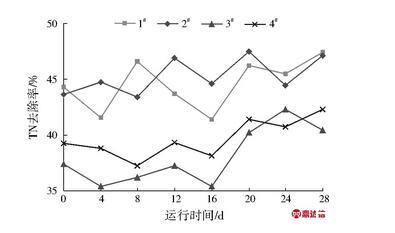
对试验期间各试验柱TN去除效果进行检测,结果见图4。1#~4#试验柱对TN的平均去除率分别为44.58%、45.28%、38.06%、39.63%,环境温度为15℃的1#、2#试验柱脱氮效率高于5℃下的3#、4#试验柱,说明环境温度是制约人工湿地脱氮效率的首要因素。其次,由于相同条件下反级配试验柱硝化效率更好,对氨氮的去除效果更高,为后续反硝化提供了更多的硝态氮底物,故虽然试验过程中正级配试验柱的反硝化细菌数量高于反级配试验柱,但相同反应温度下反级配试验柱对总氮的去除率更高,可见供给反硝化脱氮的底物浓度亦是制约脱氮效率的重要因素。由于潜流湿地设计水力停留时间普遍在24 h以上,在较长的反硝化时间下,相对较少的反硝化细菌数量亦可完成对硝态氮的反硝化反应,故相较于湿地填料层中反硝化细菌数量,填料层中供给反硝化脱氮的硝态氮底物浓度是影响湿地脱氮效果更重要的制约条件。
图4各试验柱对TN去除效果
Fig.4 The TN removal efficiency of different columns
3结论
(1)低温对正反级配人工湿地的污染物处理效率均产生明显抑制作用,环境温度为15℃的1#、2#试验柱对污染物去除效率优于环境温度为5℃的3#、4#试验柱。
(2)在相同环境温度下,反级配试验柱对于污染物去除效率优于正级配试验柱,其中2#试验柱对COD、氨氮和TN污染物的去除效率最优,其COD、氨氮和TN污染物平均去除率可分别为46.18%、45.50%、45.28%。
(3)由于反级配试验柱表层较大孔隙率使得氧气更易进入填料层,因此反级配试验柱上层氨化细菌数量、硝化细菌数量均高于同环境温度下正级配试验柱,温度越高,细菌数量差异约明显。本研究中,环境温度为15℃的反级配试验柱(2#试验柱)中氨化细菌、硝化细菌数最高。
(4)受环境温度和反硝化底物浓度影响,反硝化细菌较少的反级配填料反硝化效果较好,对TN去除效率由高至低排序为2#>1#>4#>3#。
