鼻气管鸟杆菌生长曲线测定:光电比浊法VS平板菌落计数法
为了全面解析鼻气管鸟杆菌(Ornithobacterium rhinotracheale,ORT)的增殖特性,本研究采用双轨并行检测策略:一方面通过分光光度计动态监测培养液在600nm波长下的吸光度(OD600)变化,精确捕捉菌体密度波动;另一方面运用平板菌落计数法(colony-forming unit,cfu)定量分析活菌种群动态,构建双重生长曲线进行交叉验证。实验数据揭示:两种检测方法呈现高度吻合的生长动力学特征,其中2-16小时呈现典型的指数增长趋势(对数期),16-20小时达到生长平台(稳定期),20小时后则进入菌体裂解阶段(衰亡期)。特别针对对数期末期(16h)的定量分析表明,OD600值与活菌数存在显著线性相关性,经最小二乘法拟合获得精准回归方程y=2.7591x-0.0897(R²=0.9973),该数学模型为精准调控ORT培养进程提供了量化依据。
鼻气管鸟杆菌病作为禽类呼吸道的重要疫病,其病原体ORT可通过气溶胶快速传播,临床表现为特征性呼吸困难、发育迟滞及渐进性死亡。剖检可见典型的"三炎"病变:肺脏纤维素性化脓灶、胸膜纤维蛋白渗出及气囊混浊增厚。值得注意的是,ORT常与禽流感病毒(AIV)、传染性支气管炎病毒(IBV)等形成"病原体协同网络",通过免疫抑制效应显著提升混合感染死亡率,据国际禽病学会统计,暴发疫情可导致禽群死亡率激增30%-50%,每年造成全球养禽业数亿美元损失。该病原体最早由Devriese团队于1994年从比利时病态火鸡中分离鉴定,随后呈现跨洲际传播态势,英国、以色列等15个国家相继报道疫情。我国学者陈小玲于2003年首次分离到本土菌株,基因组测序显示其与欧洲流行株存在显著遗传差异。世界动物卫生组织(OIE)最新监测数据显示,ORT的全球流行率正以每年8.7%的速率递增,已成为威胁禽类健康的重大病原体。
1材料与方法
1.1材料
1.1.1菌种
试验用鼻气管鸟杆菌由本实验室保存。
1.1.2培养基
普通肉汤培养基(PT)、哥伦比亚血琼脂基础购自青岛高科园海博生物技术有限公司;脱脂绵羊血,庆大霉素、多黏菌素购自杭州天和微生物试剂有限公司。
1.1.3主要仪器
紫外分光光度计(德国艾本德公司);电热恒温培养箱(南京实验仪器厂);台式全温振荡器(上海精宏实验设备有限公司)。
1.2方法
1.2.1比浊法测定生长曲线
取活化后鼻气管杆菌,接种于5mL普通肉汤培养基中,37℃,220r/min,培养16h,备用。将灭菌的普通肉汤培养基分装于2个250mL的锥形瓶内,每瓶30mL,分为试验组和对照组,将菌种按照1%的接种量接种于试验组的肉汤培养基中,37℃振荡培养。之后每两小时取一次样,测定试验组与对照组在不同培养时间的OD600mm值,重复测定3次取平均值,记录培养时间及对应OD600nm值。以OD600mm值为纵坐标,培养时间(t)为横坐标绘制ORT生长曲线。
目前对ORT的研究集中在诊断检测和防治技术,对于ORT的生长曲线研究报道较少。本试验主要采用光电比浊法和平板菌落计数法来绘制ORT的生长曲线,并通过测定不同浓度菌液的OD值与活菌数构建回归方程,研究该菌的繁殖规律。
1.2.2平板菌落计数法测定生长曲线
在5%绵羊血琼脂培养基(5μg/mL庆大霉素,多黏菌素)倾倒于90cm平皿中,每个平皿约20mL培养基,放置于超净台中冷却至凝固。将步骤1.2.1中不同时间的菌液,在超净台内取出200μL菌液到1.5mL无菌EP管中,且将菌液10倍递增稀释梯度稀释,取10°、10°、10°三个稀释度的菌液各200μL,在绵羊血琼脂培养基上进行涂布,每个稀释度菌液重复涂布三个平皿,并吸取200μL稀释液涂布平皿做空白对照,所有平皿于37℃,5%CO2恒温培养箱中倒置培养。培养24h后对所有的平皿进行菌落计数,计数时选取菌落数在30~300,无蔓延菌落生长的平皿,并根据公式(每毫升中菌落形成单位(cfu)=同一稀释度三次重复的平均菌落数x稀释倍数x5)换算出样品中的菌落数,以菌落数(cfu)为纵坐标,培养时间(t)为横坐标绘制鼻气管鸟杆菌的生长曲线。
1.2.3菌液OD600nm值与菌落数(cfu)的相关性分析
挑取单菌落接种于普通肉汤培养基中,37℃恒温振荡器培养16h。12000r/min离心5min取菌体,用灭菌的普通肉汤培养基重悬菌液,然后进行2倍递增稀释,将菌液稀释至1/2、1/4、1/8、1/16、1/32,测定不同稀释度菌液OD600mm值并进行平板菌落计数。根据所得结果,绘制以OD600nm值为横坐标,菌落数(cfu)为纵坐标的标准曲线。
1.2.4回归曲线准确度验证
将1.2.1中所测的菌液培养不同时段的OD600nm值代入标准曲线,得出理论菌落数(cfu),并绘制出曲线与平板菌落计数法测定的生长曲线进行比较验证。
2结果
2.1 ORT的生长曲线(比浊法)
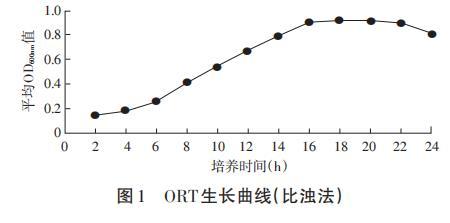
由图1可知,在2~16h曲线呈快速增长,ORT以几何级数生长,为对数生长期;16~20h曲线平缓,ORT总数处于稳定阶段,为稳定期;20h呈曲线呈缓慢下降趋势,ORT总数下降,为衰亡期。
2.2 ORT的生长曲线(平板菌落计数法)
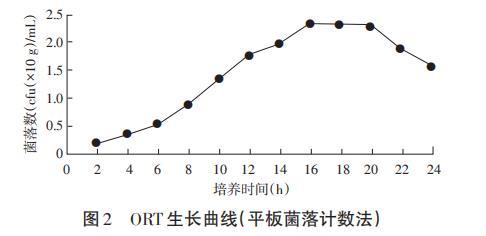
由图2可知,ORT生长同样分为3个时期:2~16h为对数生长期,16~20h为稳定期,20h以后为衰亡期,与比浊法所得生长曲线走向基本一致,但相对于比浊法衰亡期下降更迅速。
2.3菌液OD600nm值与菌落数(cfu)的相关性分析
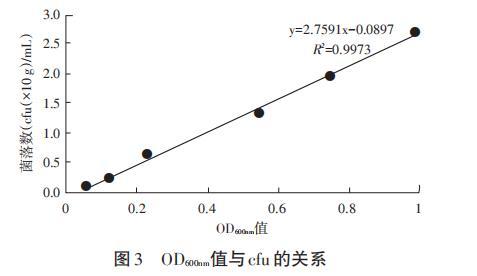
根据所测得OD600mm值及平板菌落数(cfu),以OD600mm值为横坐标,菌落数(cfu)为纵坐标绘制的标准曲线(见图3)。ORT对应方程为:y=2.7591x-0.0897(R2=0.9973),说明OD600mm值和菌落数(cfu)之间呈强相关性。
2.4回归曲线准确度验证
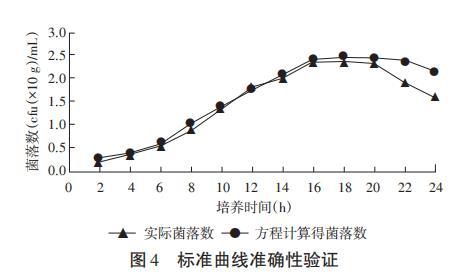
将平板菌落计数得到的菌落数(cfu)与代入方程计算得到的理论菌落数(cfu)比较,结果见图4。由图4可知,2~16h期间ORT的实际生长曲线与方程所得的理论曲线走势基本重合,数值差异较小;而16h后曲线出现偏移,平板菌落计数得出的菌落数(cfu)数值明显小于方程计算所得结果。因此该方程仅适用于ORT2~16h培养时间段内的细菌计数。
3讨论
本研究通过光电比浊法及平板菌落计数法测定ORT的生长曲线,两种方法所得生长曲线走向基本一致,由此可得出ORT的生长周期:2~16h为对数生长期;16~20h为稳定期;20h以后为衰亡期。本试验所得的ORT生长曲线与付强等测定的A型ORT的生长曲线结果基本吻合。而后本试验通过测定不同浓度菌液的OD值与活菌数构建回归方程,但是该方程仅适用于对数生长期的细菌,而这个时期细菌的形态以及生物活性等都很典型,并且对外界环境的作用敏感,因此研究细菌性状以对数生长期的细菌最好。
本试验发现,平板菌落计数法是将菌液经梯度稀释之后,取一定量的稀释液接种于平皿上,在适宜条件下培养,由每个单细菌生长繁殖而形成肉眼可见的菌落,由于待测菌液往往不易彻底分散成单个细菌,长成的单菌落也可能来自2~3个或更多细菌,因此平板菌落计数的结果往往偏低。平板菌落计数法虽然操作繁琐,试验成本高,结果滞后,但是该方法最大优点是可以测定活菌的数量,所得结果更准确。而比浊法操作简单,能即时获得结果,适合连续测定,但是也存在缺点,在一定的范围内,菌液浓度与透光度成反比,而由于在稳定期细菌代谢产物不断累积,衰亡期细菌死亡数量增多,酶标仪所测得数值为细菌的总数,无法
区分活菌和死菌,使得衰亡期菌液的OD{}_{600text{nm}}值无明显变化。因此,比浊法只能得出该菌各生长阶段的大概时间,所得生长曲线无法普遍适用。本试验选择对数期的ORT,结合比浊法与平板菌落计数法,探究了OD600mm值及平板菌落数(cfu)的关系,成功构建回归方程,综合两种方法优点的同时节约了时间和成本,有效地提高了ORT计数的准确性和简便性,为下一步研究提供保障,为根据不同需要控制ORT的生长提供参考。
