副溶血弧菌活菌计数方法:MTT比色法、ATP生物发光法和高通量生长曲线法(三)
2实验结果
2.1 MTT比色法
2.1.1检测波长
MTT经细菌产物呈蓝紫颜色,将培养的副溶血弧菌悬液进行波长扫描(图1),结果显示,蓝紫色产物的最大吸收峰值在550~560 nm之间。DMSO的吸光度对实验组吸光度影响很小,且没有峰值出现,属于背景吸收,因此,将MTT法的检测波长定为555 nm。
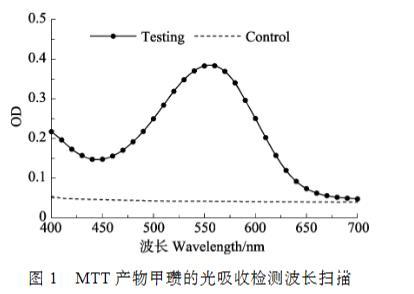
图1 MTT产物甲瓒的光吸收检测波长扫描
2.1.2 MTT溶液的使用剂量
设定不同的MTT用量进行分析,结果显示(图2),当细菌反应液中MTT浓度为0.2 mg/ml,产生甲瓒沉淀的量最多,甲瓒的吸收曲线呈现峰值,因此,将MTT终浓度定为0.2 mg/ml。MTT量超过0.2 mg/ml时,产生的甲瓒量会逐渐减少。
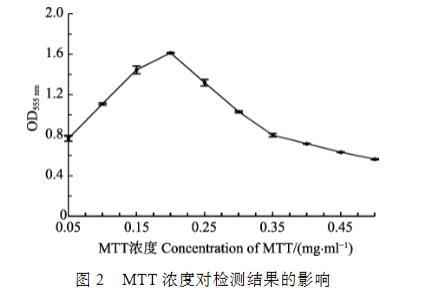
图2 MTT浓度对检测结果的影响
2.1.3干扰物的影响
以DMSO为参照,用PBS或灭活菌体作为样品进行MTT反应检测,所得的检测值很低(表1),经t检验,得出3组数据两两间均无显著差异(P>0.05),因此,可以忽略这些干扰物对实验结果的影响。

表1不同干扰物以DMSO为对照时的OD值
2.1.4反应时间的影响
细菌与MTT的反应时间在0.5~2 h时,形成甲瓒的量在逐渐增多,2 h后维持在相对稳定的数量(图3),因此,将反应时间定为2 h。
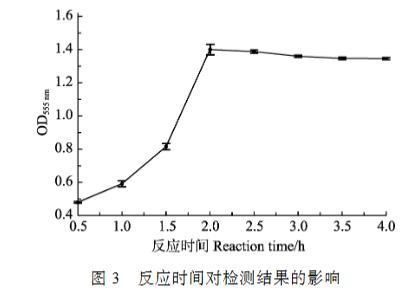
图3反应时间对检测结果的影响
2.1.5检测范围
通过选择上述参数,用优化的MTT法在微孔板中进行副溶血弧菌的高通量活菌计数,用SigmaPlot的Polynomial线性分析,当菌液浓度为7.81×106~2.50×108 CFU/ml时,其对应的OD555 nm值与活菌数的线性关系极显著,线性范围跨度约为2个细菌浓度数量级,其关系式为LgC=(1.0439±0.0200)LgOD555 nm+(8.0565±0.0125),R2=0.9965(图4)。
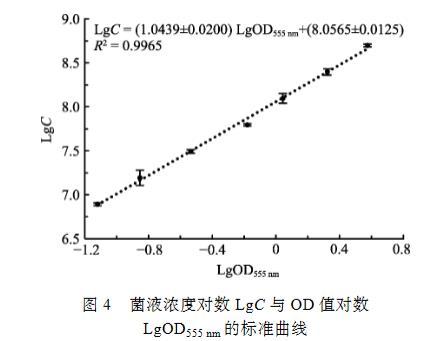
图4菌液浓度对数LgC与OD值对数LgOD555 nm的标准曲线
2.2 ATP生物发光法
2.2.1 ATP标准溶液的标准曲线
用增强型ATP检测试剂盒对ATP标准溶液进行检测,ATP标准溶液浓度在1.0×10‒1~1.0×104 nmol/L时,ATP浓度的对数(LgATP)与发光强度对数(LgRLU)的线性关系极显著,其关系式为LgATP=1.0509LgRLU-4.3223,R2=0.9974(图5),表明该试剂盒在该范围内的测定结果可靠。
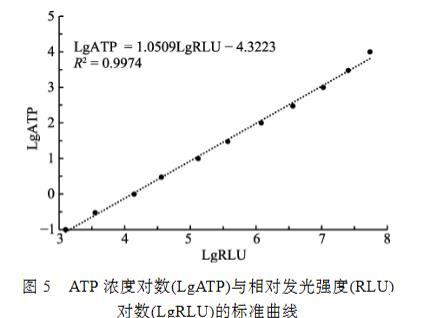
图5 ATP浓度对数(LgATP)与相对发光强度(RLU)对数(LgRLU)的标准曲线
2.2.2菌液浓度对数LgC与相对发光强度对数LgRLU的标准曲线
用增强型ATP试剂盒对已知浓度的副溶血弧菌样品进行检测,用SigmaPlot的Polynomial线性分析,当菌液浓度在1.0×104~3.0×108 CFU/ml时,其对应的相对发光强度对数(LgRLU)与活菌数对数(LgC)的线性关系极显著,线性范围跨度约为4.5个细菌浓度数量级,其关系式为LgC=(0.9590±0.0065)LgRLU+(0.9949±0.0366),R2=0.9994(图6)。
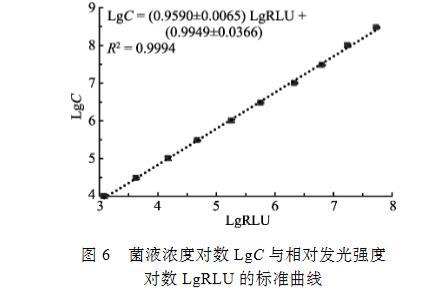
图6菌液浓度对数LgC与相对发光强度对数LgRLU的标准曲线
2.3高通量生长曲线法
将浓度为1.0×100~1.0×107 CFU/ml的副溶血弧菌加到预先加有培养基的多孔板中,每隔1 h,测定OD600 nm值,扣除未接种细菌孔的OD600 nm后,得出各初始浓度的细菌吸光度所代表的生长变化,可看到这些生长变化都呈S形(Sigmoid)曲线分布,不同浓度的S曲线在拐点处的生长速率基本接近,经SigmaPlot的Sigmoid曲线类型3参数模式拟合,得到各初始浓度的细菌生长曲线(图7)。用SigmaPlot的Polynomial线性分析,取各浓度拟合曲线的拐点时间参数(Ts),即为生长达到最大值的50%的生长时间,该时间在所测定的初始细菌浓度范围内均与活菌数的对数值(LgC)具有极显著的线性关系,线性关系跨度达7个数量级,其关系式为LgC=–(0.8727±0.0230)Ts+(9.0128±0.1572),R2=0.9924(图8)。
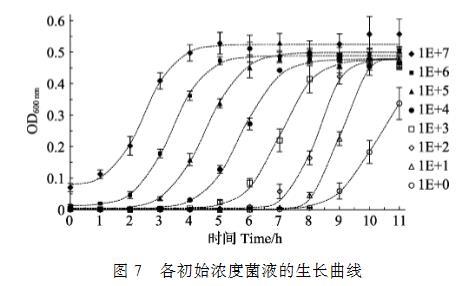
图7各初始浓度菌液的生长曲线
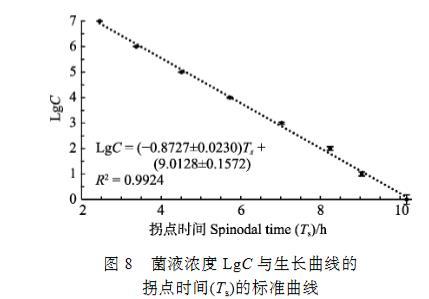
图8菌液浓度LgC与生长曲线的拐点时间(Ts)的标准曲线
相关新闻推荐
1、不同磁化水处理对有益微生物(苜蓿根瘤菌)生长及功能的影响——讨论及结论
