GR基因缺失对溶藻弧菌生物学特性及抗生素敏感性的影响(二)
1.2.2缺失株△gr的验证采用RNA试剂盒分别提取溶藻弧菌HY9901野生株和缺失株△gr的RNA,并反转录为cDNA。以cDNA作为模板,利用一对特异性引物(gr-F/gr-R)进行PCR扩增,选取野生株HY9901作为阳性对照,用10 mg/mL凝胶电泳检测。
1.2.3缺失株△gr遗传稳定性的测定溶藻弧菌缺失株△gr菌液和新鲜TSB培养基按体积比1∶100的比例连续传30代后,用引物gr-TF/gr-TR对片段进行扩增,检测缺失株△gr的遗传稳定性。
1.2.4生长曲线测定
使用丹麦Biosense微生物生长动态监测系统测定溶藻弧菌野生株HY9901和缺失株△gr的生长曲线。将过夜培养的菌液用新鲜TSB培养基稀释至初始OD600约为0.05,分装至无菌的96孔细胞培养板中,每孔200μL。将培养板置于Biosense系统中,在28℃下连续震荡培养,系统自动每30分钟监测并记录600 nm波长下的光密度(OD600)值,持续24小时。以时间为横坐标,OD600值为纵坐标,系统自动绘制实时生长曲线。每组实验设置3个重复孔,并包含仅含培养基的空白对照。
1.2.5抗生素敏感性测定
采用丹麦Biosense微生物生长动态监测系统进行药敏动力学分析。选取呋喃唑酮、头孢唑林、四环素等抗生素,用TSB液体培养基将其稀释至一系列浓度梯度。将过夜培养的野生株与缺失株菌液稀释至约1×10^5 CFU/mL,与等体积不同浓度的抗生素溶液在96孔板中混合,使每孔终体积为200μL。设置不含抗生素的菌液孔作为生长对照,仅含培养基的孔作为空白对照。将培养板置于Biosense系统中,于28℃下连续震荡培养24小时,系统自动监测并记录各孔OD600的动态变化。通过比较各浓度抗生素孔与生长对照孔的实时生长曲线,评估菌株对不同抗生素的敏感性变化。实验独立重复3次。
1.2.6生物膜的测定分别用适量新鲜TSB洗脱在TSA平板上培养的野生株和缺失株,将菌液D(600 nm)调至0.5,再分别用新鲜的TSB稀释20倍,转至96孔板中,28℃下静置24 h;用无菌ddH₂O洗涤3次,倒置晾干;用甲醇固定20 min,室温晾干,倒置30 min,在室温下加入结晶紫染液染色15 min,用自来水冲洗至澄清后自然晾干;最后加入体积分数95%乙醇,自然放置30 min,用酶标仪测定波长570 nm下的光密度值。重复3次。
1.2.7细菌泳动实验分别挑取野生株和缺失株的单菌落,穿刺接种于3 g/L的琼脂TSA平板中,放置于28℃恒温培养箱中培养24 h以上,测量两菌株的泳动圈直径。重复3次。
1.2.8胞外蛋白酶活性的测定分别将培养12 h以上的野生株和缺失株涂布于铺有玻璃纸的TSA平板上,放置于28℃下培养18 h,加入适量磷酸盐缓冲液(PBS)洗脱,以4℃、8 000 g条件离心30 min,收集上清,用孔径0.22μm滤膜过滤,所得野生株和缺失株的胞外蛋白酶产物保存于4℃。分别取100μL野生株和缺失株的胞外蛋白酶与100μL偶氮酪蛋白溶液混合均匀,用Tris-HCl缓冲液稀释至500μL,置于37℃下孵育30 min。加入适量的100 g/L三氯乙酸终止反应,以10 000 g离心10 min,收集上清,加入NaOH溶液显色,测定在波长442 nm下的光密度值,以煮沸的灭活样品作为空白对照组。重复3次。
2结果
2.1缺失株△gr的构建
以引物gr-TF/gr-TR进行检测,以野生型为对照,突变型经扩增得到1 343 bp片段,野生型扩增片段长2 648 bp(图1)。经测序,结果证实溶藻弧菌gr缺失株构建成功。
2.2缺失株△gr的验证
图2(A)表明,已构建的缺失株△gr经cDNA验证,提取得到的RNA完整。以反转录得到的cDNA为模板进行PCR扩增验证,结果表明野生株HY9901在1 400 bp处左右有特异性条带,其他的不存在条带[图2(B)],证明已成功构建了溶藻弧菌HY9901的缺失株△gr。
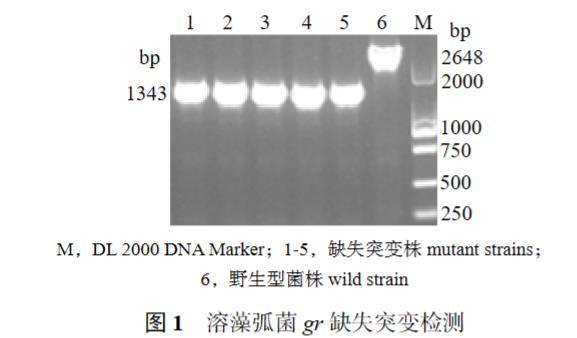
图1溶藻弧菌gr缺失突变检测
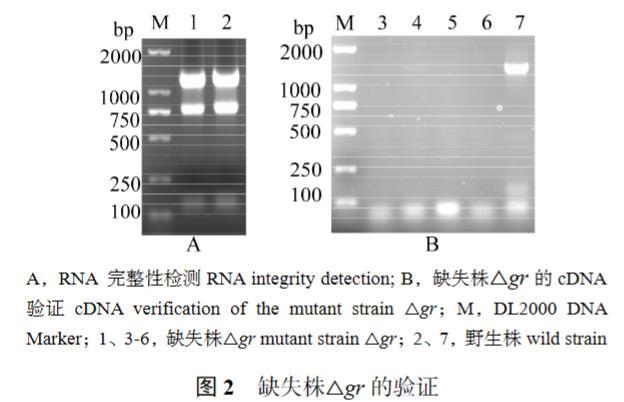
图2缺失株△gr的验证
相关新闻推荐
1、基于MALDI-TOF微生物质谱菌种快速鉴定技术,助力微生物鉴定和污染溯源调查
2、水貂李氏杆菌的分离鉴定、生化试验、药敏实验、毒力试验——材料与方法
