使用双膜溶解渗透装置研究无定形固体分散体的体外-体内关系
候选药物的低水溶性是药物开发中持续存在的挑战,估计70-90%的低分子量管道化合物被归类为水溶性差。因此,多年来人们对几种溶解度增强原理进行了研究,例如重结晶成亚稳态多晶型、非晶化、盐形成、纳米尺寸以及络合剂和脂质制剂的使用。由于缺乏适合所有水溶性差的药物的金标准方法,对于特定的目标药物可能有不止一种合适的策略。因此,一些药物以脂质制剂和无定形固体分散体(ASD)的形式上市,如非诺贝特、利托那韦和依非韦伦。当基质溶解时,药物从制剂中释放出来,因此可以进入溶液,而不必克服其结晶对应物的高晶格能。然而从药物溶解到渗透的直接转化有时会因此类过饱和系统的复杂性而变得复杂,因为过饱和溶液的表观浓度是分子溶解药物和胶体药物的量度,例如溶解在胶束中、包含在环糊精或胶体中。影响通过在垂直D/P设置中加入额外的物理屏障来实现体外-体内关系,允许在供体室和受体室中进行搅拌,此前尚未有报道。因此,本论文研究的首要目的是调查基于PAMPA的D/P设置是否可能由于PAMPA膜和供体室之间不存在物理边界而缺乏可预测性。目的是研究这种物理边界的结合是否可以成功提高D/P设置的体内可预测性。使用真空压缩成型(VCM)制备抗逆转录病毒生物药剂学分类系统II类药物EFV的基于二元聚合物的ASD,用于评估。
丹麦Biosense微生物生长动态监测系统的应用
使用oCelloScope™系统(BioSense Solutions,Farum,丹麦)对与两种屏障类型接触的药物颗粒的潜在溶解进行显微镜观察。将疏水性PVDF过滤器(0.45µm)的圆形片(ø=10 mm)放置在48孔板的孔底部,并通过添加GIT-脂质将其制备为PAMPA膜。然后用一块润湿的亲水性PVDF过滤器覆盖其中一个膜,类似于D/P设置的条件,其中PAMPA膜和供体室之间包含物理边界。在开始对屏障表面进行30分钟扫描之前,立即将磷酸盐缓冲液(29 mM,pH 7.0)中的结晶EFV悬浮液添加到两个孔中。使用UniExplorer软件版本中的背景校正吸收(BCA)算法对收集的图像进行分析。
实验结论
使用无定形固体分散体(ASD)是一种常用的制剂策略,通过克服溶出速率和/或溶解度限制来提高难溶性药物的口服生物利用度。虽然ASD的生物利用度增强已有充分记录,但建立描述体外-体内关系(IVIVR)的预测模型往往是一个挑战。假设当悬浮液中的药物有可能与渗透屏障直接相互作用时,体外溶解渗透(D/P)设置可能会高估药物吸收。与基于平行的D/P设置中的四个ASD相比,纯结晶依非韦伦的药物吸收的过度预测支持了这一点人工膜通透性测定(PAMPA)。然而线性IVIVR(R 2=0.97)是在改进的D/P设置中建立的,其中添加亲水性PVDF过滤器充当供体室和PAMPA膜之间的物理边界。
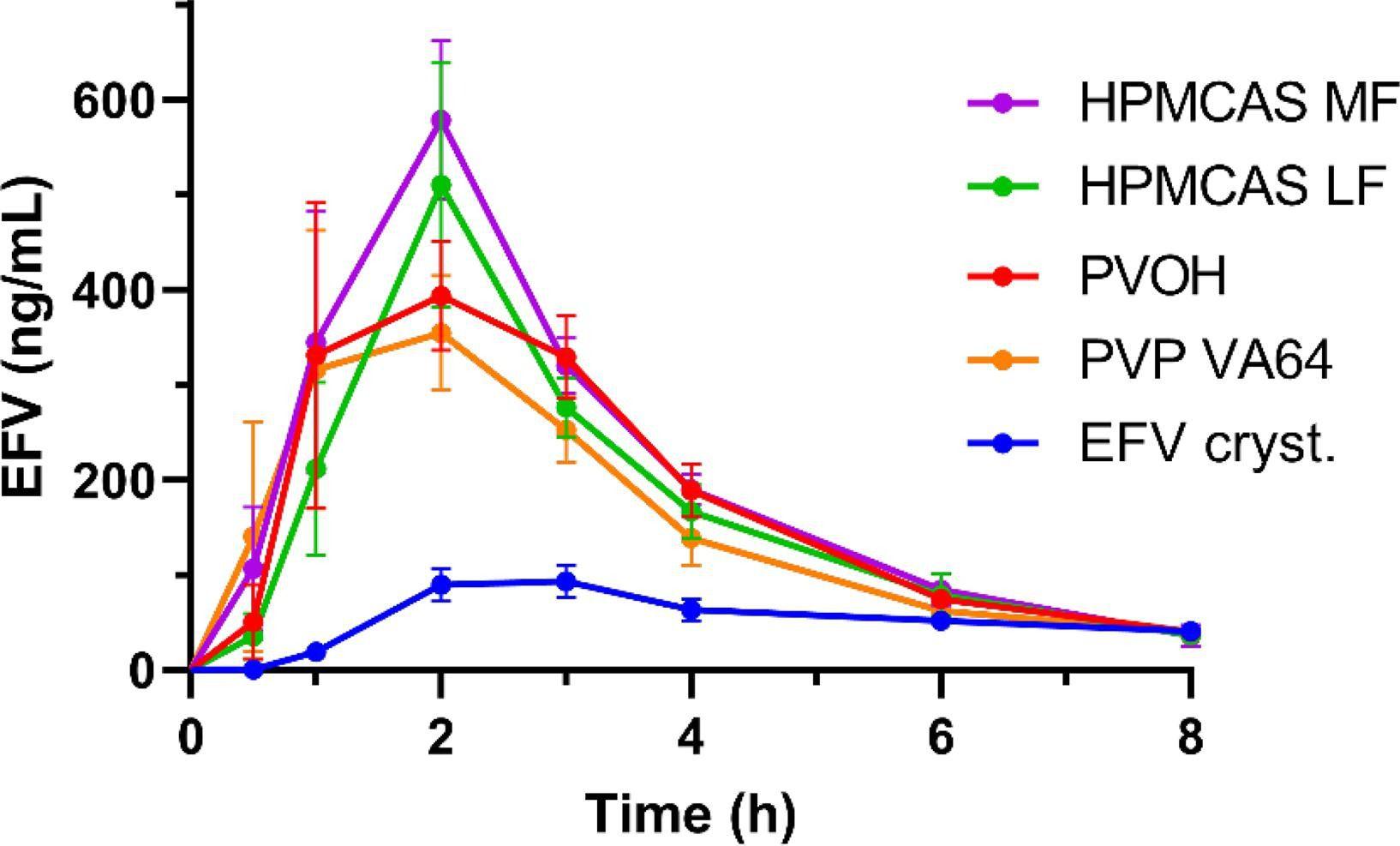
图1、口服纯结晶EFV和列出的聚合物基质中20%(w/w)EFV的四种ASD后EFV的药代动力学特征。

图2、两种测试配方经过粒度分级(180–355µm)后的扫描电子显微照片。AC:在50°C下储存四天后的纯重结晶EFV颗粒。HPMCAS AS-LF中DF ASD为20%(w/w)EFV。

图3、体外D/P设置的供体和受体室中的EFV浓度分布,包括。亲水性PVDF过滤器作为PAMPA膜和供体室之间的物理边界。将测试制剂(纯结晶EFV和4个20%(w/w)EFV的ASD,在9号明胶胶囊中列出的聚合物基质中)在t=0分钟时添加到供体隔室中。左图的虚线表示从胃部pH值3.5到肠道pH值7.0的变化。
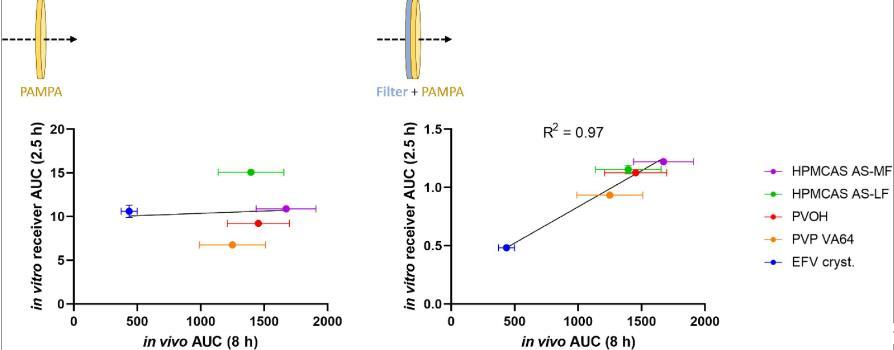
图4、两种体外D/P设置的最初2.5小时EFV接收者浓度的曲线下面积(AUC)作为大鼠EFV药代动力学曲线的完整8小时AUC的函数。五种测试制剂是纯结晶EFV和四种在所列聚合物基质中含有20%(w/w)EFV的ASD。左:仅使用PAMPA膜作为屏障的D/P设置的体外数据。右图:来自D/P设置的体外数据,其中附加的亲水性PVDF过滤器作为PAMPA膜和供体室之间的物理边界。
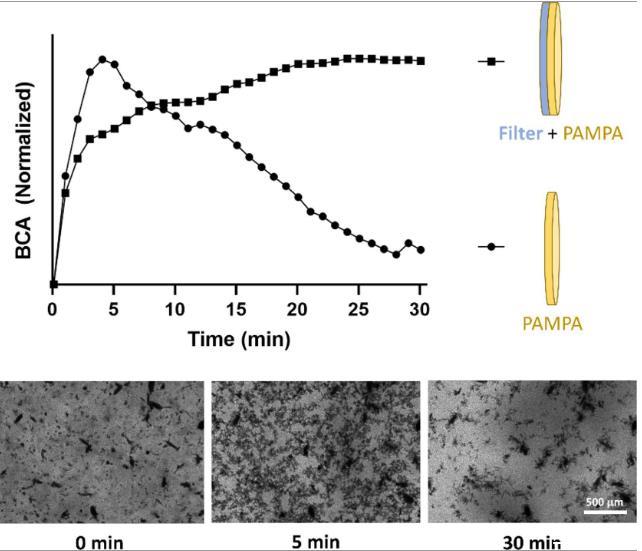
图5、将两种屏障类型浸入EFV的结晶悬浮液中,并使用oCelloScope™系统(BioSense Solutions,丹麦)监测屏障表面。被EFV颗粒覆盖的相对阻挡表面积如图所示,以添加EFV结晶悬浮液后随时间变化的归一化BCA绘制。两种屏障类型上EFV颗粒分布的图像分析。上图:标准化背景校正吸收(BCA)分析。底部0、5和30分钟后EFV颗粒在PAMPA膜表面分布的图像。
总结
本研究成功地在体外D/P设置和EFV的五种测试制剂(包括药物)的大鼠PK研究之间建立了线性IVIVR(R 2=0.97)。四种ASD(以HPMCAS AS-LF和-MF、PVOH、PVPVA64作为载体聚合物)和结晶配方。这是通过修改D/P设置来实现的,在供体室和PAMPA膜之间添加物理边界,从而防止悬浮液中的固体药物颗粒与PAMPA膜的脂质成分相互作用。基于Biosense微生物动态监测系统的显微可视化,改进的D/P设置的可预测性提高是由于避免了药物颗粒直接溶解在PAMPA膜的脂质成分中。这一原则可能有助于在启动动物模型之前对水溶性差的药物制剂进行更可靠的评估。因此在评估容易引起沉淀的制剂时,这种对通量的潜在贡献通常可能是需要排除的相关因素。因此通过引入亲水性过滤器相对容易地修改屏障,可能通过导致更准确的排序和生物利用度改善的估计,为启用制剂的制剂开发提供更强的临床前基础。
