低盐发酵甜瓣子体系中产生物胺的菌株与降解菌株能力研究【下】
3结果与分析
3.1标准曲线
生物胺标准曲线如表3所示,其回归系数R2均≥0.998,可满足检测要求。
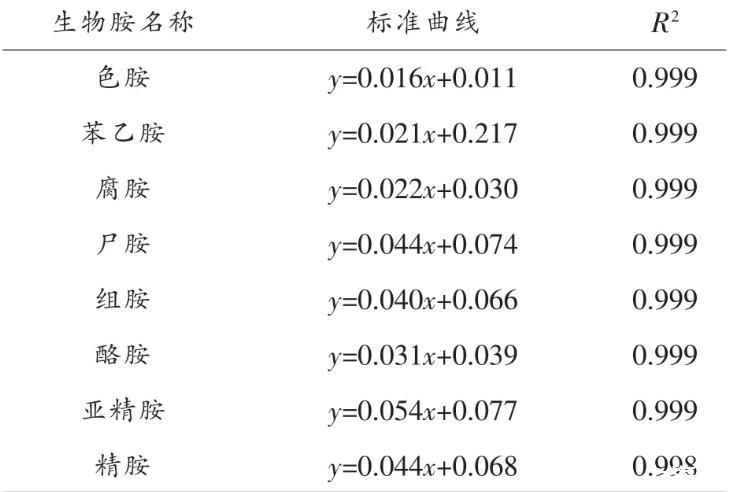
表3生物胺标准曲线
3.2产胺菌株筛选结果
3.2.1产胺菌株初筛结果由于生物胺显碱性,产胺菌株在显色培养基中呈现紫色,不产生物胺或降解生物胺菌株在显色培养基上不变色。过夜培养后得到培养基变紫的初筛菌株如图1a所示,挑取这些菌株进行分离、纯化,如图1b所示,得到产胺菌株46株。
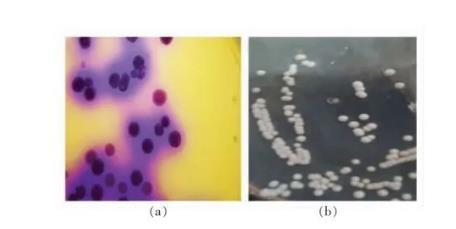
图1产胺菌株显色培养基显色形态(a)及LB平板培养形态(b)
3.2.2产胺菌株复筛结果将初筛菌株接种至生物胺液体显色培养基中,37℃培养12 h,筛选培养后培养液为紫色的菌株为产胺菌株,如图2所示,筛选得到32株产胺菌。
通过固体显色培养基初筛,液体显色培养基复筛,再经过16S rDNA、18S rDNA和ITS测序,通过BLAST比对序列,采用MEGA 7.0构建系统发育树(图2)。
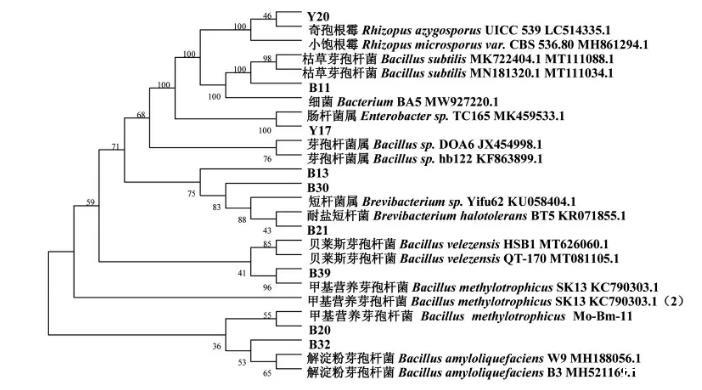
图2产胺菌株的系统发育树
结果显示甜瓣子中所筛选出代谢生物胺的菌株主要为芽孢杆菌属、短杆菌属、肠杆菌属及少量小孢根霉,这与Jeon等[15]发现韩国传统豆酱Cheonggukjang中,主要由肠球菌属和芽孢杆菌属生成生物胺的研究结果一致。
3.2.3高效液相色谱测定培养液中生物胺含量经高效液相色谱测定,得到复筛的产胺菌株培养液中生物胺含量如图3所示。
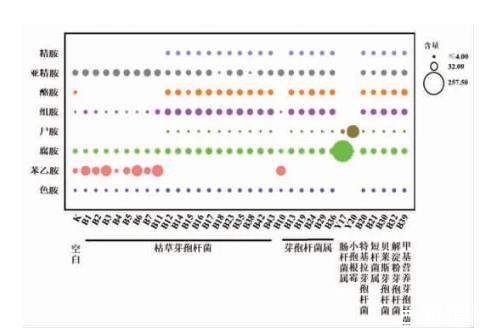
图3产胺菌株培养液中生物胺含量(mg/mL)
结合空白组进行分析可以得出,所筛出菌株培养液中生物胺总量均远高于空白组中生物胺总量,不同菌株之间产生物胺能力存在较大差异,与空白组相比芽孢杆菌属产组胺、酪胺的能力相对较强。其中,B11菌株产苯乙胺能力相对较强,含量达78.4 mg/kg;B16菌株产酪胺能力相对较强,含量达25.3 mg/kg。Y17菌株和Y20菌株具备较强的产腐胺、尸胺能力,其培养液中含量分别达257.5 mg/kg和92.8 mg/kg,挑选这4株菌株回接至甜瓣子发酵体系验证产胺能力。
3.3高产胺菌株回接至不同盐度甜瓣子模拟体系中产生物胺的能力
高产生物胺菌株回接结果如图4所示。可看出,6%盐度体系中生物胺含量远高于9%和12%盐度体系,且8种生物胺均有检出,生物胺总量最高达4 207.6 mg/kg。对照组发酵过程主要产酪胺、腐胺、组胺和色胺,有少量尸胺检出。该盐度下,除B11号菌株外其余各菌株体系中生物胺总量均高于食品中生物胺建议总量1 000 mg/kg[16]。其中,B16回接体系中酪胺含量相对较高,含量为1 194.4 mg/kg,高于Ten等[17]、Nout等[18]提出的食品中酪胺为100~800 mg/kg的限量标准;Y17体系中腐胺含量较高,含量为3 363.9 mg/kg;Y20回接体系中高产尸胺,为1 160.4 mg/kg,表明6%盐度发酵甜瓣子可能存在较大安全风险。
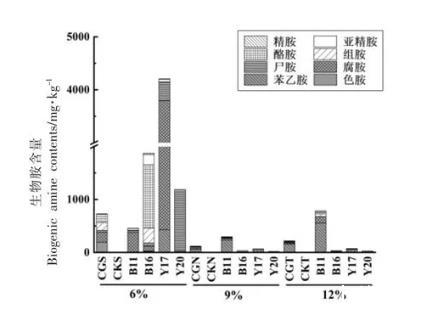
图4高产胺菌株回接6%、9%、12%盐度甜瓣子模拟体系后产胺能力
在9%和12%含盐量甜瓣子样品中,生物胺总量最高分别为233.9,781.2 mg/kg,其生物胺组成相似。9%盐度下B11高产苯乙胺220.06 mg/kg;12%盐度下B11高产腐胺119.4 mg/kg、苯乙胺546.5 mg/kg,远高于30 mg/kg的推荐量[17]。B16、Y17、Y20菌株在9%、12%盐度回接体系中不产色胺,产生物胺种类和含量随盐度增加而减少,与对照组生物胺变化趋势较为一致,可能是盐对其生长起到了一定程度的抑制作用所致。精胺和亚精胺在不同含盐量甜瓣子样品中含量均较低。因此,实现甜瓣子低盐化发酵不能一味的追求降低盐的含量。
3.4生物胺降解菌株筛选结果
3.4.1不产胺菌株筛选结果挑选46株课题组前期从甜瓣子中筛选出的不同种属菌株,活化后接种至生物胺液体显色培养基中,筛选得到39株不产生物胺的菌株,主要为酵母菌、乳酸菌(表4)。
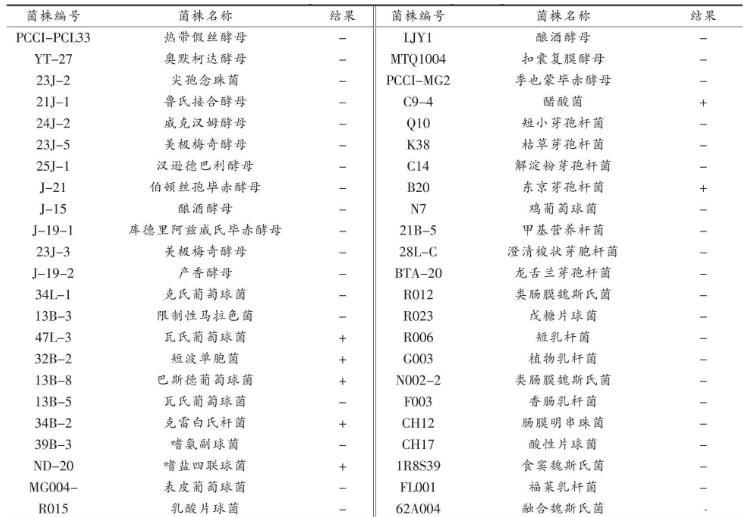
表4不产胺菌株筛选结果
3.4.2生物胺降解菌株初筛结果将上述不产胺菌株未变紫培养液衍生后于300 nm波长下检测其荧光强度,初筛出降胺菌株。荧光检测筛选结果如图5所示。
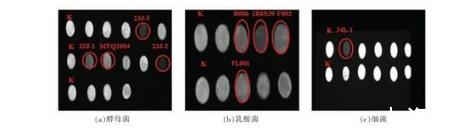
图5降胺菌株初筛荧光检测结果
选取荧光强度弱于空白组的菌株,初步断定为降解生物胺菌株(图5),共筛选出降解生物胺菌株9株,其中酵母菌4株,乳酸菌4株,细菌1株。
3.4.3生物胺降解菌株复筛结果将上述菌株回接至生物胺质量浓度为100 mg/L的BAs培养液,30℃培养12 h后,空白组未观察到菌株的生长,其余组菌株均有生长,于620 nm波长下测定其吸光度值,从而判定其在以生物胺为唯一氮源的培养基下的生长状况,结果如图6所示。
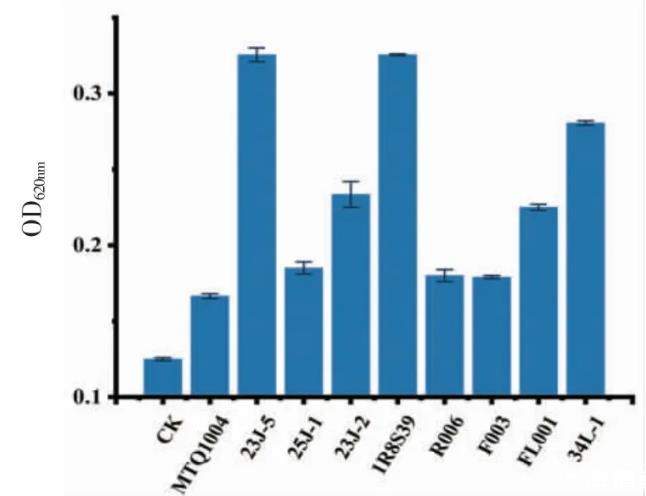
图6降解生物胺菌株BAs培养液OD值
研究结果表明,初步筛选的9株菌均具备降解生物胺的能力。其中,美极梅奇酵母23J-5、食窦魏斯氏菌1R8S39在BAs培养基下生长状况较好,表明其降解生物胺的能力可能较高。荧光检测结果显示,9株菌株荧光强度均弱于空白组的菌株(图7),表明其均为生物胺降解菌。

图7生物胺降解菌株荧光检测结果
3.4.4降胺菌株BAs培养液降解能力测定使用高效液相色谱测定各菌株BAs培养液生物胺含量并计算其降解率,结果如图8所示。所筛选菌株都具有一定生物胺降解能力,然而均无法降解亚精胺,不同菌株降解不同种类生物胺的能力差异较大。9株菌株对色胺的降解率在14.10%~21.37%之间;苯乙胺的降解率在5.94%~20.09%之间;腐胺的降解率在14.46%~24.94%之间;尸胺的降解率在23.52%~30.82%之间;组胺的降解率在5.65%~33.43%之间;酪胺的降解率在4.75%~15.10%之间;精胺的降解率在34.67%~65.58%之间;其中,扣囊复膜酵母MTQ1004具备较强的降解腐胺、组胺、精胺能力,其降解率分别为24.94%,33.43%,65.58%;美极酶奇酵母23J-5具备较强的降解尸胺、酪胺能力,降解率分别为30.82%,15.10%;香肠乳杆菌F003具备较强的降解苯乙胺和色胺能力,降解率分别为20.09%,21.37%,且能降解除亚精胺外的其余7种生物胺。通过比较分析可知,扣囊复膜酵母(MTQ1004)和香肠乳杆菌(F003)的生物胺降解率相对较高,与杨利昆等[19]、赵佳迪[11]研究结果较为一致。
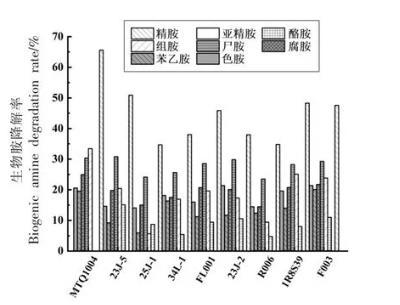
图8降胺菌株BAs培养液的生物胺降解率(%)
3.5降胺菌株回接甜瓣子模拟体系验证结果
3.5.1降胺菌株回接甜瓣子模拟体系的降解能力测定将上述降胺菌株回接至含100 mg/L生物胺的甜瓣子模拟体系中培养16 d,提取衍生后,通过高效液相色谱法测定生物胺含量,结果如图9所示。由于尖包念珠菌为有害菌,因此不考虑回接应用。其中,降胺能力最强的是香肠乳杆菌F003,与前期筛选结果一致,其对苯乙胺的降解率高达100%,对危害较大的组胺、酪胺和精胺的降解率分别可达57.61%,25.52%,45.99%;扣囊复膜酵母MTQ1004对苯乙胺和腐胺的降解率达100%,对组胺降解率为37.78%;其余菌株对各种生物胺均有一定的降解能力。
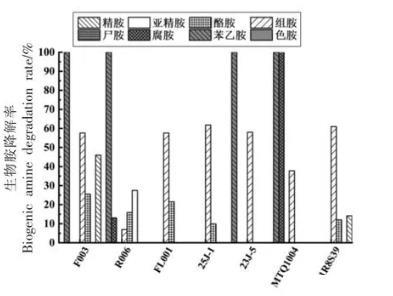
图9甜瓣子模拟体系中的生物胺降解率(%)
在甜瓣子模拟体系下,菌株降解率与对应菌株降解生物胺能力强弱较为一致。而降解生物胺种类数量减少,这与该菌株降解生物胺能力特性有所不同,可能是因为甜瓣子正常发酵时,环境因素对菌株降解生物胺能力造成影响所致[20]。
3.5.2降胺菌株回接甜瓣子模拟体系的感官评价由图10可以看出,在回接纯种发酵体系中,所筛选出降胺菌株发酵的甜瓣子感官评价结果存在一定差异。其中,生物胺降解能力较强的扣囊复膜酵母MTQ1004具有生物胺降解能力,而强化发酵的甜瓣子霉味较重,以腐臭味、氨味为主,感官品质相对较差;生物胺降解菌株香肠乳杆菌F003强化发酵所得的甜瓣子同正常发酵的甜瓣子相比,其酯香、酱香味较浓,所得甜瓣子样品感官品质最佳,可以考虑用作低盐化甜瓣子中的降胺发酵菌株。
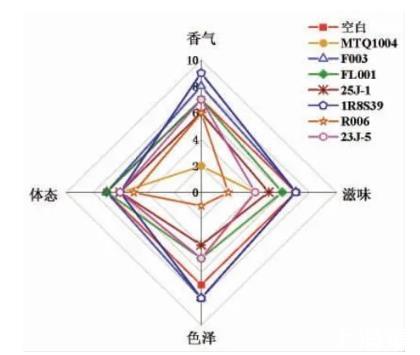
图10降胺菌株回接甜瓣子模拟体系的感官评价
4结论
本研究从4%盐度甜瓣子中筛出产生物胺菌株32株,其中肠杆菌属Y17、小孢根霉Y20、枯草芽孢杆菌B11和B16产生物胺能力最强,主要产酪胺、尸胺、腐胺、苯乙胺。盐度对菌株产生物胺能力有明显抑制作用,将4株菌株回接至甜瓣子发酵体系中,其中6%发酵体系含有大量生物胺,9%和12%发酵体系中产生物胺明显得到抑制。
筛选出降解生物胺菌株9株;筛选出1株可用于甜瓣子低盐化发酵的降胺菌株香肠乳杆菌F003,它能有效降解苯乙胺、组胺、酪胺和精胺等生物胺,在生物胺含量为100 mg/L时,降解率分别为100%,57.61%,25.52%,45.99%,且回接体系中感官品质最佳,具有较好的生长能力,可考虑为甜瓣子低盐发酵时的降胺菌株。
相关新闻推荐
2、3株奥默柯达酵母生长曲线、pH耐受性、最适生长温度测定及对酱油香气和滋味影响(三)
3、基于细菌生长曲线测定探究具核梭杆菌促进肺癌发展的潜在机制(一)
