双歧杆菌分离鉴定、耐受性试验、益生特性试验及安全性评价(二)
1.3.2胆盐耐受能力试验
将上述供试菌悬液按照2%(v/v)的接种量接种于胆盐浓度0.3%的MRS培养基中,37℃厌氧培养24 h,使用Biosense自动生长曲线分析系统于600 nm处测定A值。选取生长12 h后菌体密度增长较大的菌株进行后续试验。
1.3.3模拟人工胃肠液试验
选择耐受性较好的双歧杆菌菌株,按照上述试验方法制成供试菌悬液,人工胃液、人工肠液配置及实验方法参照Liu等所用方法进行,计算存活率。胃液存活率(%)=N1/N0×100%,肠液存活率(%)=N2/N1×100%,式中:N0表示0 h的活菌数(CFU/mL),N1表示在胃液中培养3 h的活菌数(CFU/mL),N2表示在肠液中培养4、8 h的活菌数(CFU/mL)。
1.3.4表面疏水性测定
采用碳氢吸附法,对菌株的表面疏水性进行测定,培养至3代的菌液以3 505×g离心5 min后弃上清液,无菌PBS缓冲溶液洗涤2次后重悬,调整菌悬液浓度使其在600 nm处的A值为1.0,菌悬液加入等体积二甲苯,震荡使其充分混匀,静置60 min使之分层,于600 nm处测得下层A1值,计算菌株疏水性。菌株疏水性(%)=(1−A1/A0)×100%,式中:A0为初始吸光度,A1为处理后吸光度。
1.3.5菌株表面自聚集能力测定
对菌株进行表面自聚集能力测定,按1.3.4所述方法制备菌悬液,37℃厌氧培养,于0、2、4、6、8、12、24 h分别测定菌悬液上层在600 nm处的A值,计算菌株自聚集能力。菌株自聚集能力(%)=(1−At/A0)×100%,式中:A0为初始吸光度,At为t时间吸光度。
1.3.6抑菌能力测定
选取大肠埃希菌等4种致病菌作为指示菌,使用牛津杯法检测双歧杆菌对致病菌的抑菌能力,观察抑菌圈,直至抑菌圈清晰停止培养,测量并记录抑菌圈直径。
1.4安全性评价
1.4.1抗生素耐药性测定
使用药敏纸片琼脂扩散法测定双歧杆菌对20种抗生素的敏感性,测量并记录抑菌圈直径。
1.4.2溶血试验
将活化后菌株划线于体积分数6%的脱纤维绵羊血固体平板上,37℃培养48 h,并进行阳性对照(金黄色葡萄球菌),记录菌株生长情况。
1.4.3菌株全基因组测序和注释
将菌株于MRS液体培养基中活化并传代培养,按1.2.1所述方法收集菌体细胞,经液氮极冷后送至北京诺禾致源科技股份有限公司进行全基因组测序。对原始测序数据进行过滤,使用SOAP denovo v 2.0软件对高质量reads进行组装,以基因组大小、Saffold数量、GC含量作为指标进行评估,采用CapCloser软件对内部Gap进行填充和单碱基校正,完成组装。基于毒力基因数据库(VFDB)对菌株FYF41-14蛋白序列进行比对,设置参数阈值为相似度>85%、E值<1e-15、序列匹配长度>300 bp。基于综合抗生素耐药基因数据库(CARD)对菌株FYF41-14蛋白序列进行比对,设置参数阈值为相似度>85%、E值<1e-15、序列匹配长度>300 bp。
1.5统计学方法
每组实验设置3个平行,应用SPSS 26.0软件进行显著性分析。符合正态分布的计量数据用平均值±标准差表示,两样本以上数据比较采用单因素方差分析,计数资料采用百分率表示,组间样本均数比较采用t检验。检验水准α=0.05。
2.结果
2.1双歧杆菌分离鉴定
对样本进行分离纯化后,获得239株疑似双歧杆菌,菌落形态呈现边缘整齐、表面光滑或粗糙3种形态,颜色多为白色、乳白色或淡黄色的圆形菌落,且239株菌均为革兰阳性菌。显微镜观察发现菌体细胞多数呈现V型或Y型杆状。
利用DNA提取试剂盒提取双歧杆菌基因组DNA,利用紫外分光光度计进行DNA浓度和纯度的检测,结果显示所有菌株DNA浓度均在100~3 000 ng/L,纯度(A260/A280)均在1.8~2.0,表明菌株DNA提取成功。进一步对检测合格的DNA片段采用PCR进行扩增,并采用1%的琼脂糖凝胶电泳进行检测,结果显示,所有菌株在1 500 bp处均有明亮清晰的条带,且无拖尾现象。综上表明分离株16S rRNA基因的PCR扩增产物满足后续的测序和分析要求。
测序得到菌株序列,通过NCBI数据库中已有数据对序列进行同源性比对,将同源性大于99%的菌株与同一种水平的模式株进行系统发育关系分析,部分菌株的系统发育结果如图1所示,239株菌株均鉴定为双歧杆菌。
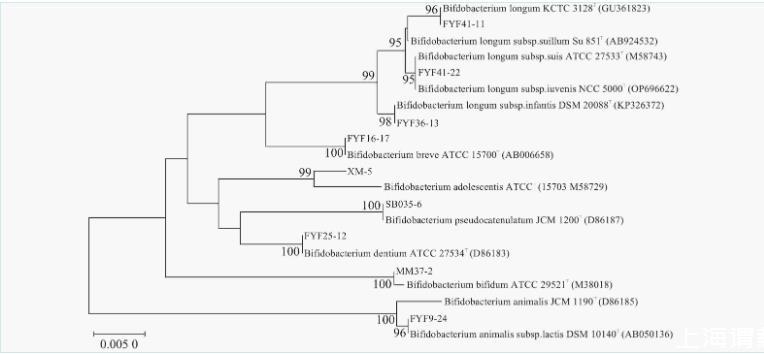
图1双歧杆菌系统发育树
鉴定结果如图2A所示,其中数量最多为长双歧杆菌(57.32%),其次为假小链双歧杆菌(17.99%),齿双歧杆菌数量最少(0.42%)。儿童样本共计分离到107株,隶属6个种,优势菌种为长双歧杆菌(56.07%)。成人样本中分离得到132株,包括5个种,优势菌种为长双歧杆菌(58.33%)。值得关注的是,短双歧杆菌、齿双歧杆菌仅在儿童样本中存在,两歧双歧杆菌仅在成人样本中存在。
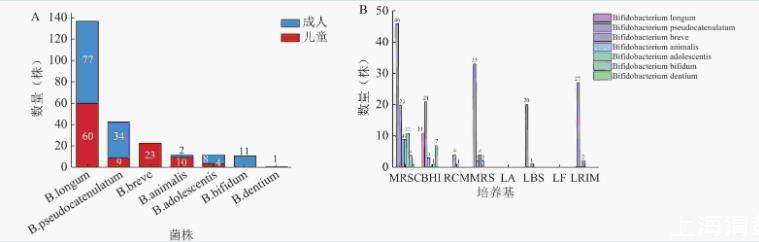
图2双歧杆菌分离鉴定情况
注:A为不同年龄段样本双歧杆菌分离鉴定结果;B为不同培养基双歧杆菌分离情况。
分析不同培养基对可培养物种丰富度的影响,结果如图2B所示,我们发现MRSC共计分离到100株(41.84%),BHI为43株(17.99%),其余培养基为MRS(17.15%)、LRIM(12.13%)、LBS(8.79%)、RCM(2.09%),LF、LA中未分离得到双歧杆菌,MRSC、BHI两种培养基的双歧杆菌分离率和分离物种丰富度均较高,MRSC可分离到7个种的双歧杆菌,BHI可分离到5个种。
相关新闻推荐
1、梅花鹿体细胞航天诱变、细胞样品回收培养技术、生长曲线及核型特性(三)
3、环链棒束孢2018BY-1菌株生长曲线测定方法——引言、材料与方法
