胶滴肿瘤药敏检测技术检测及评价不同药物浓度的5'-DFUR对胃癌的疗效(一)
近年来早期诊断和外科手术技术的发展,为癌症患者带来了希望。然而,胃癌作为中国发病率和病死率均较高的恶性肿瘤之一,复发率和转移率也较高,所以术后辅助化疗仍然是胃癌综合治疗的重要组成部分。由于肿瘤的异质性,即使同一化疗方案,不同患者产生的疗效也差异显著,因此,选择适合个体的化疗药物,既可提高疗效避免不必要的不良反应,同时也可减轻患者的经济负担。胶滴肿瘤药敏检测技术(collagen gel droplet embedded culture drug sensitivity test,CD-DST)是利用胶原凝胶在37℃时形成三维立体结构的特点,将肿瘤细胞包埋于胶滴中,模拟体内实体肿瘤细胞生长的微环境,从而在相似的生长环境中评价化疗药物的有效率。CD-DST具有原代细胞培养成功率高、所需细胞量少、检测药物种类多等优点,使肿瘤个体化治疗成为可能。该技术在肿瘤体外药敏检测中的应用研究已有十余年的历史。卡培他滨(capecitabine,CAP)作为5-氟尿嘧啶(5-fluorouracil,5-FU)的前体药物,也是胃癌辅助化疗的常用药,由于其不良反应小,疗效显著,已被广泛应用于临床。相较于其他抗肿瘤药物,CAP具有更好的安全性和有效性。但截至目前未有研究报道在胃癌辅助化疗中CAP的CD-DST培养条件,故本研究对CAP的CD-DST检测条件进行探索,对胃癌患者术后采用CD-DST法进行CAP体外药敏实验进而指导临床CAP用药具有重要意义。
口服给药后,CAP首先被肝脏中羧酸酯酶代谢为5'-脱氧-5-氟胞苷(5'-deoxy-5-fluorocytidine,5'-DFCR),然后通过肝脏和肿瘤组织中的胞苷脱氨酶将其转化为5'-脱氧-5-氟尿苷(5'-deoxy-5-fluorouridine,5'-DFUR),最后在肝脏和肿瘤组织中胸苷磷酸化酶(thymidine phosphorylase,TP)的作用下,将5'-DFUR进一步代谢为5-FU发挥抗肿瘤作用。研究证实,TP是一种与肿瘤相关的血管生成因子,在肿瘤细胞中的表达高于正常细胞,这可能是一些研究者报道的恶性肿瘤优先将5'-DFUR转化为5-FU的重要原因之一。TP的活性决定了CAP的抗肿瘤效力。由于CAP代谢过程复杂不仅需要多种酶同时参与,并且需要肝脏起始代谢,体外代谢比较受限,无法实现CAP的体外CD-DST检测及评价,而5'-DFUR仅需在肿瘤细胞中经TP关键酶的一步代谢就可转化为发挥抗肿瘤作用的5-FU,故本研究选择CAP的代谢产物5'-DFUR进行CAP的CD-DST检测条件探索。
本研究选取65例新鲜胃癌组织标本,体外通过对不同药物浓度的5'-DFUR进行CD-DST检测及评价,并分析5'-DFUR在胃癌术后辅助化疗中的敏感性与临床有效率的一致性,进而确定CD-DST法评价CAP进行药敏检测的实验条件。
1对象与方法
1.1研究对象
选取2015年5月至2017年9月北京多家综合性三级甲等医院的65例胃癌患者的新鲜肿瘤组织标本。患者纳入标准:①术前经胃镜活检病理诊断为胃癌;②无严重全身系统性疾病;③无远处转移。排除标准:①术前采用化疗或放疗;②合并其他肿瘤;③有其他脏器切除。65例患者年龄38~87岁,性别、分型均随机选取。将65例新鲜胃癌组织标本根据入组时间顺序分为实验组31例和验证组34例。
1.2主要试剂与仪器
DME/F-12 1∶1培养基购自美国HyClone公司;胎牛血清购自美国Thermo Fisher公司;乙二醇二乙醚二胺四乙酸(ethylene glycol diethyl ether diamine tetraacetic acid,EGTA)、伊立替康(irinotecan,CPT-11)购自美国Sigma公司;5'-DFUR购自日本TCI公司;奥沙利铂(oxaliplatin,L-OHP)购自比利时CENEXI-Laboratoires THISSEN S.A.公司;胶滴药敏检测试剂盒Primaster®购自日本Kurabo公司。倒置显微镜购自日本Olympus公司;Primage图像分析系统购自日本Kurabo公司。
1.3 CD-DST法
1.3.1原代肿瘤细胞分离与培养首先用生理盐水洗涤肿瘤组织标本5次,然后用眼科剪将肿瘤组织标本剪成小块,同时尽量去除如脂肪、黏膜、结缔组织、坏死组织等非肿瘤细胞组织,再用刀片将组织切碎成泥状,EZ酶消化1~2 h,1300 r/min离心3 min,收集消化后的肿瘤细胞团块,将其接种于CG培养瓶中,用PCM-1培养基在37℃、5%CO2培养箱中预培养24 h,获得原代胃癌细胞。
1.3.2胶原凝胶滴培养培养24 h后,收集预培养的贴壁细胞,与试剂盒中胶原混合液(A∶B∶C=8∶1∶1)混合均匀,按照每胶滴30μl,每孔3个胶滴,将细胞悬液接种于6孔板中,2 h后待胶滴凝固加入3 ml含10%胎牛血清的DME/F-12 1∶1培养基,于37℃、5%CO2培养箱中过夜培养。
1.3.3抗肿瘤药物接触与清洗培养24 h后加入抗肿瘤药物,药物测试条件根据药物服用特点、以往的研究结果及参考文献,分别设未用药物的阴性对照孔(Control)以及L-OHP和CPT-11(临床胃癌常用药)处理的阳性对照孔,同时将0-time组(加药起点的未处理组)进行染色固定。培养相应时间后,用DME/F-12 1∶1培养基清洗2次,每次15 min,然后用无血清培养基PCM-2继续培养5天,其中第3天更换一次培养基。
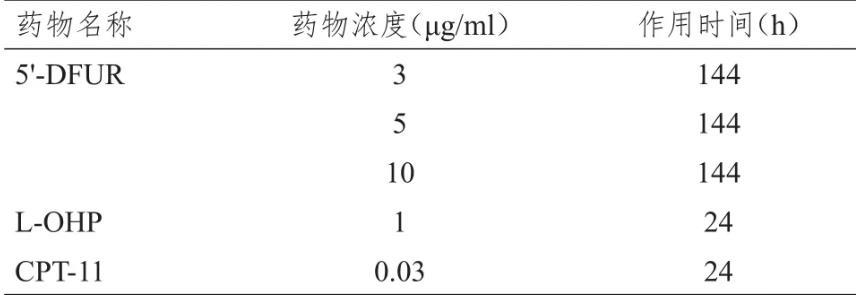
表1抗肿瘤药物接触条件表
1.3.4染色固定与扫描第9天进行染色固定,使用终浓度为50μg/ml的中性红染色2 h,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞3次,每次5 min,中性福尔马林固定45 min,蒸馏水清洗15 min,通风干燥,分析具有活性的肿瘤细胞。(图1)
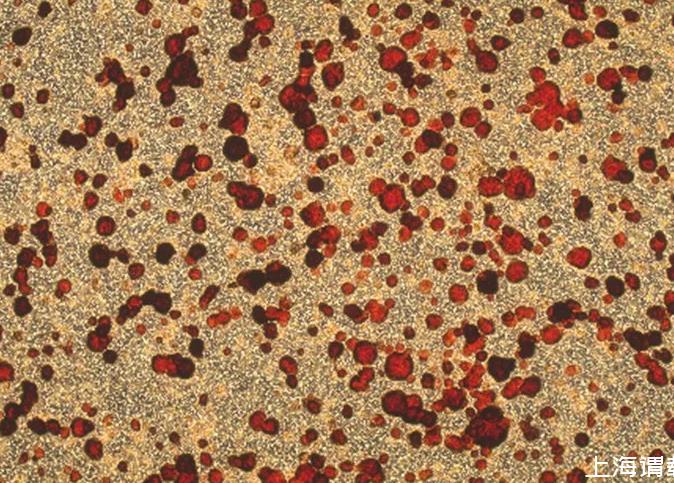
图1染色固定干燥后的胃癌细胞(中性红染色,×40)
1.4数据分析
采用Primage图像分析系统对胶滴进行分析。Control组吸光度(optical density,OD)值与0-time组OD值的比值表示生长率,若生长率小于0.8,则判定为检测没有意义。
药物敏感度通过加药组OD值/Control组OD值(T/C)表示,若T/C<50%,说明个体肿瘤细胞对相应药物敏感度较高(高敏感);T/C为50%~60%,说明个体肿瘤细胞对相应药物敏感度处于高敏感与低敏感的临界范围(临界);T/C>60%,说明个体肿瘤细胞对相应药物敏感度较低(耐药)。
相关新闻推荐
2、10种硫醚类香料对金黄色葡萄球菌生长曲线、nuc基因表达量的影响(三)
