香芹酚对恶臭假单胞菌生长、运动能力、产胞外蛋白酶和生物被膜能力影响(二)
1.3.2泳动性和群集性测定
培养基配制好后,按1.3.1节方法配制含有不同体积分数香芹酚的菌悬液并设置空白对照和DMSO对照。摇匀后,各接种3μL样品溶液至泳动性和群集性平板中央。将平板于30℃恒温培养箱中培养24 h后,测量菌株蔓延分散距离。
1.3.3嗜铁素产生情况测定
按1.3.1节方法配制含有不同体积分数香芹酚的菌悬液并设置空白对照和DMSO对照。培养基凝固后,每孔加入100μL稀释的恶臭假单胞菌样液。将平板于30℃恒温培养箱中培养24 h后,测量嗜铁素平板中黄色晕圈的直径。
1.3.4胞外蛋白酶的测定
LB营养琼脂灭菌冷却至约50℃后,将LB营养琼脂与单独灭菌的脱脂奶粉混匀,使脱脂奶粉的最终质量分数为1.0%,倒平板,并用牛津杯打孔,备用。将恶臭假单胞菌过夜培养活化,并调节OD600 nm约为1.00,按1∶1 000的比例加入到LB肉汤中,按1.3.1节方法配制含有不同体积分数香芹酚的菌悬液并设置空白对照和DMSO对照。摇匀后,分别向打孔平板中加入100μL样液,将平板置于30℃培养箱培养24 h后,使用游标卡尺测量3组脱脂奶粉琼脂平板中透明圈的直径。
1.3.5生物被膜形成能力的测定
将恶臭假单胞菌过夜活化至OD600 nm约为1.00,用LB肉汤以1∶100的比例稀释,按1.3.1节方法配制含有不同体积分数香芹酚的菌悬液,同时做空白对照和DMSO对照。取200μL上述菌液于96孔板中,将96孔板置于30℃培养箱下静置培养24 h,吸去孔中的菌液,残留生物被膜用200μL去离子水洗涤3次。向每个生物被膜孔添加200μL 0.1 g/100 mL结晶紫溶液,28℃染色20 min。染色后的生物被膜用200μL去离子水冲洗3次,吸干,最后加入等体积95%乙醇洗脱5 min后,使用酶标仪测定OD600 nm,以此表征恶臭假单胞菌的生物被膜形成能力。
1.3.6核酸泄漏量的测定
将恶臭假单胞菌接种至肉汤培养基,于28℃水浴振荡器中活化24 h,吸取菌悬液于4℃、8 000 r/min离心5 min后收集沉淀,并用磷酸盐缓冲溶液洗涤、重悬并调整菌悬液至OD600 nm约为1.00,按1.3.1节方法配制含有不同体积分数73香芹酚的菌悬液并设置空白对照和DMSO对照。将样品置于28℃水浴振荡器中振荡培养活化,分别于15、30、45、60 min取菌悬液,4℃、8 000 r/min离心5 min,使用移液器吸取上清液,并用紫外-可见分光光度计测定OD260 nm。
1.3数据处理
每组实验做3次以上平行重复,采用IBM SPSS Statistics 26软件进行数据分析,采用Duncan’s多重比较对数据进行差异显著性分析,P<0.01表示差异极显著;采用Origin 2021软件作图。
2结果与分析
2.1香芹酚对恶臭假单胞菌生长曲线的影响
由图1可知,空白对照组和DMSO对照组恶臭假单胞菌生长曲线十分相似,在0~6 h生长迅速。采用香芹酚处理后,恶臭假单胞菌的生长速率变缓,且随着香芹酚含量升高,其生长受到的抑制愈加明显。与2个对照组相比,香芹酚体积分数为0.005%时,恶臭假单胞菌的生长受到轻微抑制,香芹酚体积分数为0.010%时,恶臭假单胞菌生长受到明显抑制。当香芹酚体积分数≥0.015%时,其延迟期延长至16 h以上,且在16 h以后,其生长也十分缓慢。结果表明,当香芹酚在体积分数≥0.015%时对恶臭假单胞菌的生长具有良好的抑制作用。
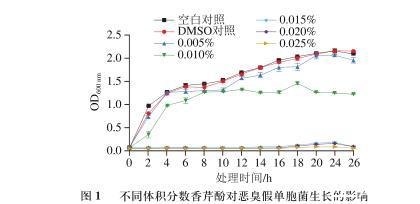
图1不同体积分数香芹酚对恶臭假单胞菌生长的影响
2.2香芹酚对恶臭假单胞菌泳动性和群集性的影响
由图2A可知,空白对照组和DMSO对照组的泳动性菌落较大,表明恶臭假单胞菌具有较强的运动能力。随香芹酚含量升高,恶臭假单胞菌的移动距离呈现明显减小趋势,当香芹酚体积分数≥0.010%时,对恶臭假单胞菌的泳动性有明显的抑制作用。由图2B可知,随香芹酚含量升高,恶臭假单胞菌的移动距离呈现明显减小趋势,当香芹酚体积分数≥0.015%时,对恶臭假单胞菌的群集性有明显的抑制作用。结果表明,香芹酚可明显削弱恶臭假单胞菌的运动能力,且体积分数越大,效果越好。Wang Yaying等研究香芹酚对荧光假单胞菌泳动性和群集性的影响发现,香芹酚对荧光假单胞菌的运动有很强的抑制作用,与本研究结果较为一致。
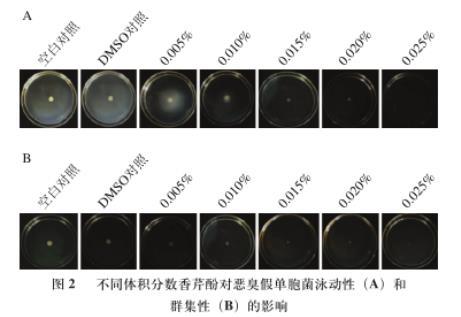
图2不同体积分数香芹酚对恶臭假单胞菌泳动性(A)和群集性(B)的影响
