脓肿分枝杆菌胞内菌落计数、对RAW264.7细胞血红素氧化酶1调控自噬影响(三)
1.2.6胞内菌落计数
细胞内菌落计数操作如下:培养并调整RAW264.7细胞浓度2.5×105个/ml,取2 ml加到6孔板中,待细胞完全贴壁后,分别加入终浓度分别为30μmol/L CoPP和30μmol/L SnPP预处理12 h,加入M.abs(MOI=5)共孵育2 h,无菌PBS漂洗3次,加入含34μg/ml阿米卡星完全培养基作用2 h以清除胞外M.abs,无菌PBS漂洗后继续加入终浓度30μmol/L CoPP和30μmol/L SnPP继续培养48 h。刺激完毕,弃上清,无菌PBS漂洗3次,加入300µl无菌去离子水裂解细胞,振荡混匀后置冰上裂解20 min,加入含0.1%SDS、5%BSA无菌裂解液1 ml进一步裂解细胞,将裂解液吸入无菌EP管,13 000 r/min离心15 min,弃上清,加入300µl无菌7H9培养基重悬沉淀。取50µl悬液放入96孔板进行倍比稀释,每个稀释度取10μl接种于哥伦比亚血平板,置于37℃培养箱中培养3~5 d,进行菌落计数,各组菌落计数结果与M.abs对照组进行标准化处理后进行统计学分析。
1.2.7 ELISA实验
细胞按照实验设计处理完成后,ELISA检测TNF-α蛋白分泌。按照试剂说明书进行操作,吸取100μl培养上清液、标准品加到96孔酶联板中37℃孵育1 h,弃上清,每孔加入A工作液100μl,封板,37℃孵育1 h;弃上清,每孔加入350μl洗液,洗板3次,每次2 min,最后一次用吸水纸把残留液体吸干;每孔加入B工作液100μl,封板,37℃孵育30 min;洗板3次,每次2 min,每孔加入90μl基质液,37℃避光孵育10~20 min;每孔加入50μl终止液,置波长450 nm酶标仪比色。
1.3统计学分析
所有Western blot图片灰度值均由Image J软件进行计算,所得的数据均由Excel收集,并采用Prism8.0绘图,SPSS20.0进行统计分析。各组之间比较采用one-way ANOVA分析,Levene检验方差齐性,方差不齐采用Dunnett T3方法比较,P<0.05认为差异具有统计学意义。
2结果
2.1 M.abs对RAW264.7细胞HO-1表达影响
如图1A、B结果所示,与无菌对照组比较,M.abs在MOI=5时,HO-1表达最高,MOI=10、15时,HO-1表达量逐渐减少(P<0.001)。图1C、D结果显示,与0 h相比较,M.abs刺激8~24 h,HO-1表达升高,24 h达到最高峰,但24~48 h后有表达下降趋势(P<0.001)。CCK-8检测细胞活性结果发现,与无菌对照组相比,M.abs与RAW264.7细胞共孵育48 h,细胞活性无显著改变(图1E)。
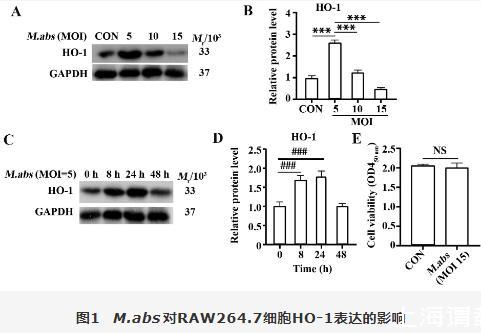
图1 M.abs对RAW264.7细胞HO-1表达的影响
2.2 M.abs诱导RAW264.7细胞自噬蛋白表达
图2结果显示,随着MOI的增加,Atg5、LC3Ⅱ蛋白表达量逐渐增加,自噬流标志物p62蛋白表达量也增加。说明M.abs诱导自噬小体形成的同时,自噬溶酶体降解受阻。
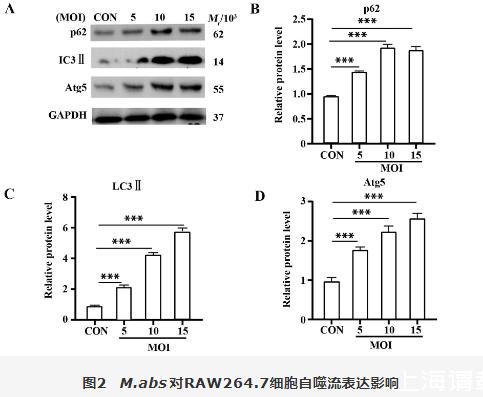
图2 M.abs对RAW264.7细胞自噬流表达影响
2.3 HO-1参与调控M.abs诱导的自噬相关蛋白表达
图3结果显示,30μmol/L CoPP能诱导HO-1大量表达,显著抑制Atg5、LC3Ⅱ表达,增加p62聚集。30μmol/L SnPP显著增加Atg5表达和LC3Ⅱ表达,p62减少。图3F结果显示,单独30μmol/L CoPP和30μmol/L SnPP与细胞共孵育48 h,CCK-8检测细胞活性无显著差异。
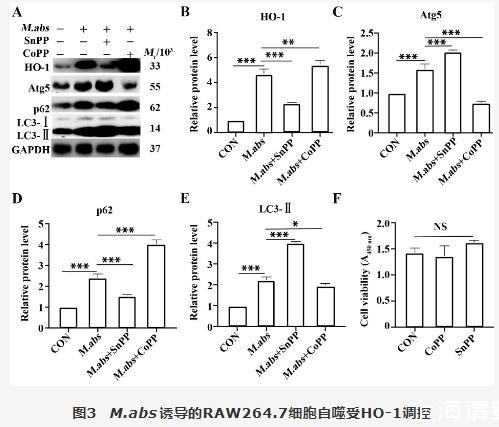
图3 M.abs诱导的RAW264.7细胞自噬受HO-1调控
2.4抑制HO-1增加溶酶体酸性区域改变
LysoTracker Red溶酶体染色结果显示(图4A),与M.abs组相比较,M.abs+CoPP组胞浆溶酶体荧光比M.abs荧光稍弱,SnPP+M.abs组胞浆溶酶体表达显著增多(红色区域),而3-MA+M.abs组和BafA1+M.abs组胞浆溶酶体显著减少。图4B结果为各组溶酶体(红色区域)平均荧光值定量结果,SnPP+M.abs组与各组相比差异具有统计学意义(P<0.001)。
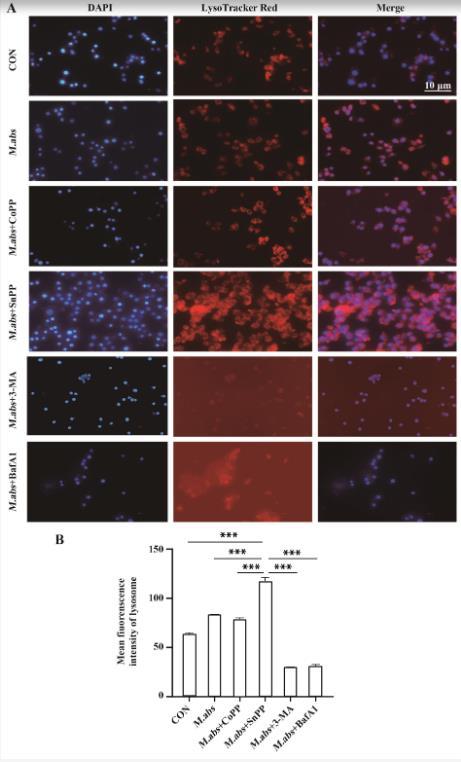
图4 HO-1调节M.abs感染的溶酶体酸性区室改变
2.5抑制HO-1减少M.abs胞内存活及炎症反应
采用30μmol/L CoPP和30μmol/L SnPP分别与M.abs共孵育48 h,CCK-8结果显示,各组中M.abs细菌活性差异无统计学意义(P>0.05,图5A),说明此浓度的CoPP和SnPP对M.abs生长没有抑制作用。细胞内菌落计数结果显示,与M.abs组比较,CoPP+M.abs组胞内菌落计数差异无统计学意义(P>0.05),而SnPP+M.abs组胞内菌落计数显著减少,差异有统计学意义(P<0.001,图5B)。CCK-8检测胞内细菌活性结果和胞内菌落计数结果相似(图5C)。ELISA结果显示,与M.abs组比较,SnPP+M.abs组TNF-α蛋白分泌显著减少(图5D),差异具有统计学意义(P<0.001)。
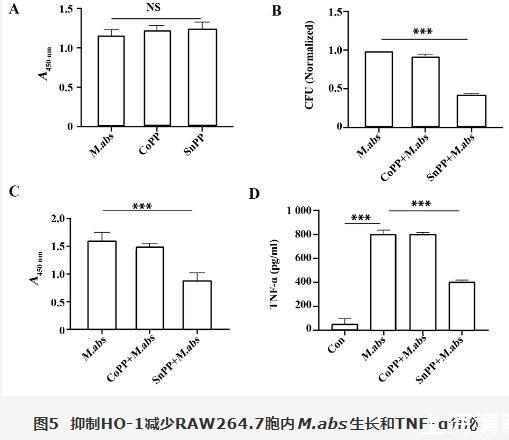
图5抑制HO-1减少RAW264.7胞内M.abs生长和TNF-α分泌
相关新闻推荐
1、五种常用抗真菌药物对198株白色念珠菌最低抑菌浓度【药敏试验】
