草鱼呼肠孤病毒培养与滴度测定、及在草鱼、CIK细胞上的生长特性研究(二)
1.3.3灵敏性试验及标准曲线绘制对重组质粒10倍梯度稀释后,进行荧光定量PCR扩增。参照SYBR Green荧光定量试剂盒说明书,分别取稀释好的重组质粒1μL为模板进行PCR扩增。反应体系为:2×SYBR GreenⅠPCR反应混合液10μL,10 pmol/L的上、下游引物各1μL,加ddH2O补足20μL。反应采用三温循环,程序为:95℃预变性10 s;95℃变性5 s,56℃退火30 s;72℃延伸15 s,40个循环,并收集荧光信号。
1.3.4特异性试验分别取GCRV 873毒株、传染性造血器官坏死症病毒(IHNV)、鲤鱼春季病毒血症病毒(SVCV)核酸,以其为模板进行Realtime PCR扩增,20μL体系加模板1μL,并设立阴性对照。
1.4病毒培养与滴度测定
将保存于液氮中的GCRV 873毒株接种于长成致密单层的CIK细胞,28℃吸附1 h;吸弃病毒液,加入与培养液等量的维持液(含2%FBS的M199),28℃恒温培养。每日观察细胞形态,直至出现80%细胞病变,收取病毒液进行滴度测定。GCRV873的细胞培养液经反复冻融后作连续10倍梯度稀释,取10-3~10-108个稀释度,每个稀释度取100µL的病毒液接种于96孔板上的单层CIK细胞;每稀释度接种8孔,28℃孵育1 h后弃去,加入维持液继续培养,并设正常细胞为对照,连续观察7 d。根据病变情况,按Karber氏法计算半数组织培养感染剂量(TCID50)。lgTCID50=L+d(s−0.5)。式中:L为病毒最低稀释度的对数,d为组距(稀释系数),s为各组病变数与接种数比值之和。
1.5 GCRV 873株在CIK细胞上的生长特性研究
CIK细胞培养于24孔细胞板,待细胞长至致密单层时,弃去培养液,用1×104TCID50/mL,每孔100μL的GCRV 873毒株感染细胞。感染后分别于0、2、4、8、10、12、24、36、48、72 h收取病毒细胞培养液,应用建立的Real-time PCR方法检测定各时间点的病毒RNA增殖情况,并通过对各个时间点病毒滴度的测定,检测病毒拷贝数,同时分别显微镜观察0、12、24、36、48、72 h的CIK病变情况。
1.6 GCRV 873株在草鱼体内的生长特性研究
试验鱼用MS222溶液(1 mg/L)麻醉,每尾草鱼腹腔注射TCID50为1×106的GCRV 0.1 mL,对照组每尾注射同等剂量的灭菌生理盐水。于注射后1、2、3、5、7 d取样,每组随机选取4尾试验鱼,用MS222(1 mg/L)麻醉后,取其肝脏、脾脏、肾脏,用Trizol提取各组织RNA后反转录为cDNA,应用Real-time PCR方法测定肝脏、脾脏、肾脏中的病毒含量。
1.7数据分析
荧光定量PCR反应结束后,查看扩增曲线和Ct值等;通过标准曲线换算得到样品中内参基因β-actin和病毒基因组的绝对拷贝数,再经β-actin校正得到相应的相对拷贝数。
2结果
2.1 Real-time PCR检测方法的建立
用特异性荧光定量引物VP6-U/VP6-L对病毒核酸进行PCR扩增,将得到的产物进行琼脂糖凝胶电泳分析,发现扩增片段与预期大小(102 bp)一致,且特异性好(图1)。将扩增片段克隆到pMD-18T后送测序,发现序列与Genebank上公布的序列一致。从不同稀释度的标准品Real-time PCR扩增反应(图2)可以看出,从1×101~1×106个拷贝数的质粒扩增曲线均呈“S”型,且与指数增长期的扩增曲线平行,反映出PCR的扩增效率相近,检测灵敏度为1×101个病毒粒子。以质粒拷贝数的对数为X轴,以Ct值为Y轴,根据两者的相关性得到标准曲线Y=3.237×log(X)+39.63,其相关系数R2为0.999,扩增效率为103.7%。特异性试验结果显示(图3),GCRV病毒核酸扩增曲线呈“S”型,而IHNV、SVCV及阴性对照均没有扩增曲线,说明所建立的检测方法特异性好。
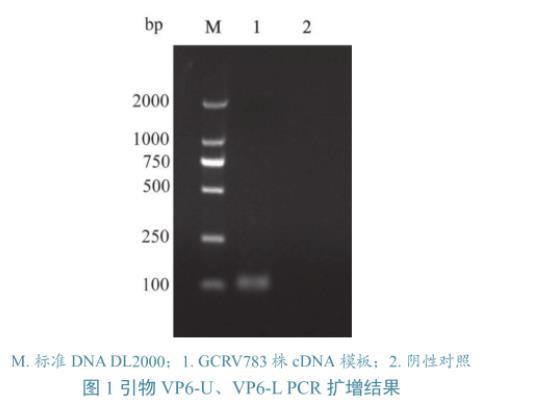
图1引物VP6-U、VP6-L PCR扩增结果
相关新闻推荐
1、十二酸单甘油酯对PEDV感染3D4/21巨噬细胞活性、基因表达的影响(一)
