基于革兰氏阳性菌生长曲线等指标评价纤维素基抑菌材料L-Met改性MCC(M-MCC)抑菌效果(二)
1材料与方法
1.1材料与试剂
L.monocytogenes购自美国农业部食品安全检验局;S.aureus购自美国模式培养物集存库。
MCC上海沪试实验室器材股份有限公司;高碘酸钠、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、L-Met、过硫酸钾、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)(均为分析纯)上海麦克林生化科技有限公司;甲醇(色谱纯)、二甲基亚砜(分析纯)、乙二醇(分析纯)广东光华科技股份有限公司;硼氢化钠(分析纯)江苏强盛功能化学股份有限公司;无水乙醇(分析纯)无锡市亚盛化工有限公司;盐酸(分析纯)南京化学试剂股份有限公司。
1.2仪器与设备
JJ2000B电子天平常熟双杰测试仪器厂;524G恒温磁力搅拌器上海梅颖浦仪器仪表制造有限公司;DHG-9240A电热鼓风干燥箱上海一恒科学仪器有限公司;SCIENTZ-10N冷冻干燥机宁波新芝冻干设备股份有限公司;FE28 pH计、电导率仪瑞士Mettler Toledo公司;恒温培养箱宁波江南仪器设备有限公司;BKQB75L高压蒸汽灭菌锅山东博科生物产业有限公司;M2E全波长酶标仪美国BioTek公司;紫外分光光度计上海精密科学仪器有限公司;LL 600300傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪美国PerkinElmer公司;Sigma 300扫描电子显微镜(scanning electron microscopy,SEM)、LSM900激光共聚焦显微镜德国Zeiss公司。
1.3方法
1.3.1 M-MCC的合成总流程
M-MCC的制备总流程如图1所示。
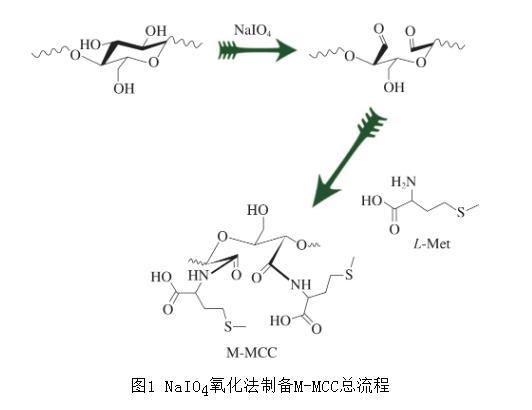
图1 NaIO4氧化法制备M-MCC总流程
1.3.2 MCC的氧化活化
原始的MCC样品性质较为稳定,难以直接进行接枝。需采用高碘酸钠氧化法对MCC进行开环氧化,生成双醛基纤维素(dialdehyde cellulose,DAC),再进行下一步的接枝。
MCC氧化成DAC的步骤如下:准确称取24.063 g高碘酸钠(NaIO4),用去离子水溶解,转移到250 mL容量瓶中,超声30 min使其完全溶解。称取10 g MCC样品粉末,置于烧杯中并加入所配的0.37 mol/L NaIO4溶液250 mL,用0.1 mol/L的盐酸调节pH值到4左右。用锡纸将烧杯完全包裹以营造黑暗条件,以40℃、600 r/min搅拌180 min,随即加入6 mL乙二醇结束反应,调节pH值到8左右再继续搅拌30 min,静置30 min。将所得到的悬浮液倒入3 500 Da的透析袋中透析48 h,期间每8 h将析出溶液更换为去离子水。经冷冻干燥后得到氧化的MCC,即DAC。
1.3.3 L-Met的功能化接枝
称取10 g上述所得DAC,根据DAC与所用L-Met物质的量比为1∶1称取L-Met,并将二者混合在250 mL去离子水中,在40℃、400 r/min的条件下搅拌混匀5 min后加入5 mL二甲基亚砜,并继续搅拌反应6 h。然后加入5 g硼氢化钠(NaBH4),静置至无气泡产生后,加入6 mL无水乙醇终止反应。使用去离子水洗涤所得产物2~3次后,将所得产物转移至透析袋用去离子水透析48 h,期间每8 h更换去离子水,以除去产物中掺杂的过量离子。最后冷冻干燥得到最终产物M-MCC。
1.3.4 M-MCC表征分析
1.3.4.1微观形貌及结构
采用SEM对改性后的M-MCC表面微观结构进行观察,样品通过喷金提高电导率后进行测试,在不同放大倍数下进行拍照。
1.3.4.2表面官能团和元素分析
通过FTIR对M-MCC进行表征,扫描范围为4 000~400 cm-1,以确定材料的成功合成。通过能量色散X射线谱(energy dispersive spectrometer,EDS)以及X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)测试M-MCC中各元素的分布和存在情况。
1.3.4.3 X射线衍射(X-ray diffraction,XRD)和热重分析
通过XRD表征了M-MCC的晶体结构,射线为CuKα,加速电压为40 kV,加速电流为15 mA,扫描速率2°/min,扫描范围2θ为5°~90°。
通过热重分析仪(thermogravimetric analysis,TGA)表征M-MCC的热稳定性和受热分解过程。
1.3.5抑菌性能测定
1.3.5.1 M-MCC的体外抗氧化活性测定
将M-MCC加入去离子水中配制成不同质量浓度梯度的悬浮液,质量浓度梯度设置为0.1、0.5、1、5、10、20 mg/mL。
使用7 mmol/L的ABTS阳离子自由基溶液与过硫酸钾溶液在25℃黑暗条件下反应12 h,以生成稳定的氧化ABTS阳离子自由基。用0.2 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)稀释ABTS阳离子自由基溶液至用紫外分光光度计检测在734 nm波长处的吸光度为0.65~0.75,保存溶液备用。稀释后的ABTS阳离子自由基溶液取200μL与20μL不同浓度梯度的样品溶液混匀,并在黑暗条件下静置反应10 min后在734 nm波长处测定溶液的吸光度。同时以抗坏血酸作为反应的阳性对照。ABTS阳离子自由基清除率按下式计算:
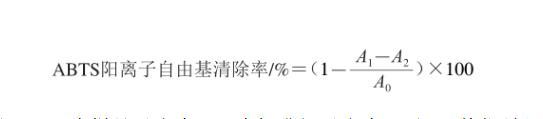
式中:A0为空白实验组的吸光度(以超纯水代替样品);A1为样品吸光度;A2为标准组吸光度(以PBS替代稀释后的ABTS阳离子自由基溶液)。
1.3.5.2 M-MCC的MIC和最小杀菌浓度(minimum bactericidal concentration,MBC)的确定
MIC是指无法以肉眼观察到细菌生长的抑菌剂最低抑制浓度。MIC和MBC的测定:将得到的M-MCC以1、5、10、15、20 mg/mL的质量浓度梯度溶解于10 mL的无菌液体培养基中。液体培养基为3 g/100 mL的胰蛋白大豆肉汤。向其中加入100μL浓度为106 CFU/mL的菌悬液,置于37℃恒温培养箱中培养24 h。观察菌体生长情况和培养液浑浊情况,24 h后培养液依然澄清的M-MCC最小浓度即为M-MCC的MIC。取100μL培养液均匀涂布在固体培养基表面,置于37℃恒温培养箱培养24 h,观察菌落生长情况。没有菌落生长的最小M-MCC浓度即为M-MCC的MBC。
相关新闻推荐
2、不同种类、浓度可同化氮蓝莓果酒中酵母菌计数、生长速率(一)
