工程菌大肠杆菌EcN FGF19-01培养、生长曲线测定及改善慢性结肠炎作用研究(一)
炎症性肠病(inflammatory bowel disease,IBD)是一种特发肠道的慢性疾病,主要包括克罗恩病(Crohn disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),目前病因尚不明确,临床常表现为急性疼痛、腹泻和血便等症状,严重影响患者的生活质量。近年来IBD的发病率和流行率在世界各地呈上升趋势,目前IBD以药物治疗为主,其主要用于缓解或维持缓解症状,目前尚未有完全治愈的方法。
IBD临床治疗药物主要有水杨酸类、糖皮质激素类和免疫抑制剂类。水杨酸类药物(如5-氨基水杨酸)可通过降低肠内促炎症因子的释放发挥抗炎作用,临床常用于轻度至中度症状的肠炎患者,但水杨酸类药物具有较严重的胃肠道等不良反应,也有报道称可能引起肾损伤;糖皮质激素类药物(如氢化可的松、泼尼松)通过抑制致炎物质(如前列腺素、白三烯)的释放缓解炎症,临床常用于中度至重度症状的肠炎患者,但长期或大量服用易产生耐药性及多种不良反应;免疫抑制剂类药物如硫唑嘌呤、肿瘤坏死因子α(tumor necrosisfactor-α,TNF-α)抑制剂,可抑制炎性细胞增殖,临床主要用于诱导缓解或维持缓解临床治疗困难的激素依赖性克罗恩病(Crohn's disease,CD),但患者服用后容易引起恶心、呕吐和腹泻等不良反应。总之,尽管水杨酸类药物、激素类药物或免疫抑制剂类药物等能缓解IBD的临床症状,但均存在停药易复发、长期使用患者依从性低等不足。
近年来大量研究显示,补充益生菌或工程菌在IBD的治疗中取得了较好的效果,能有效缓解其临床症状。益生菌凭借其固有的肠道亲和力,被视为改善肠道健康的潜力候选者。然而,天然菌株在治疗上的效果往往有限。合成生物学技术的兴起为开发基因工程细菌提供了创新途径,有望成为破解这些难题的新策略。大肠杆菌E.coli Nissle 1917(EcN)是自1917年发现以来已在人类中使用来治疗各种胃肠道和代谢疾病,包括炎症性肠病、肠易激综合征和苯丙酮尿症等。EcN菌不会在人体中定植,且人体摄入一周后粪便中即检测不到该菌的存在,故具有良好的安全性和遗传易处理性。而且,EcN菌已被批准使用作为底盘菌开发特异性的治疗各种疾病的活菌药物。例如,Praveschotinunt等人构建了诱导表达卷曲融合的三叶因子(TFFs)的工程化EcN,利用阿拉伯糖作为诱导剂成功促使EcN分泌TFFs,并显著缓解了DSS诱导的结肠炎。
人成纤维细胞生长因子19(FGF19)是一种24 kDa的蛋白质,是在回肠末端特异性合成并分泌的细胞因子,属于FGFs的特殊成员之一,与啮齿动物体内FGF15同源;两者的组织分布相似,有时被称为FGF15/19。FGF19最初是在胎儿大脑中发现的,被认为在早期神经元发育中起着关键作用。后续在表达FGF19的转基因小鼠发现其代谢率增加和肥胖减少现象,揭示了FGF19参与代谢调节,进一步研究发现FGF19参与胆汁酸生物合成途径的反馈抑制。FGF15/19在回肠中响应胆汁酸的吸收而表达分泌,胆汁酸释放至回肠结合法尼酯X受体(FXR),进而促进FGF15/19的转录表达;FGF19进入门静脉循环,通过降低肝脏CYP7A1(催化胆固醇转变为7α羟基胆固醇,胆汁酸合成的第一限速步骤)活性,从而负反馈抑制肝脏新胆汁酸合成。
研究表明,DSS诱导的小鼠结肠炎模型中,回肠FGF15表达显著下降(NatureCommunications 2014,5:4573);接受回肠切除术的患者或克罗恩病人血清FGF19显著降低(Journal of Crohns&Colitis 2015,9:125-31)。研究表明,小鼠敲除FGF15、FGFr4或Klb,将导致粪便中胆汁酸含量升高,诱发腹泻(Cell Metabolism 2005,2:217-25)。肠炎状态下肠道FXR表达显著下降,破坏胆汁酸负反馈通路FXR-FGF19/15,补充低剂量的人重组FGF19恢复肠道胆汁酸内稳态,缓解DSS诱导的慢性肠炎的发生发展(NatureCommunications 2020,11:3612)。以上研究说明FGF19表达分泌异常及其胆汁酸合成代谢失调是慢性肠炎发生发展的关键因素。因此,通过基因和药物干预或增强FGF19作用似乎是一种潜在的改善慢性结肠炎的有效手段。
1、大肠杆菌EcN的培养
利用LB(Luria-Bertani)培养基培养大肠杆菌。LB液体培养基的配制(1L):在950mL ddH2O中加入胰化蛋白胨(tryptone)10g;酵母提取物(yeast extract)5g;NaCl 10g。用1M的NaOH调节pH值到7.0,固体培养基中额外添加15g琼脂粉;ddH2O定容至1L。121℃,20min高压灭菌,细菌培养全程在超净台中操作,大肠杆菌按照1∶100比例接种,8-12h生长至对数期,经离心收集,用含20%甘油的PBS冻存细菌。
活细菌浓度测定:细菌经37度水浴解冻,利用PBS按10倍梯度稀释菌液,分别稀释至10-2、10-3、10-4、10-5、10-6、10-7、10-8,然后将10-7和10-8的两个浓度菌液涂布到固体培养皿中;24h之后计算菌落数目,根据稀释倍数计算出细菌原液的活菌数。以菌落形成单位(CFU,Colony-Forming Units)表示单位体积中的细菌的群落总数。
2、表达FGF19工程化EcN的设计
细菌内源性FnrS的启动子(PfnrS)在氧气存在下是无活性的,但在厌氧或微氧条件下与FNR结合被激活;基于此,采用了PfnrS启动子驱动FGF19的表达,从而使工程菌被口服灌胃后在肠道深处无氧/微氧情况下得以启动目标基因的表达。人源FGF19基因的CDS序列经密码子优化(E.coli Codon Usage Analyzer 2.1)后连接细菌内源ompA的信号肽序列,然后与rrnB T1终止子序列一起组成PfnrS+ompA信号肽+FGF19 CDS+rrnB T1终止子的表达框,表达框全长1020 bp核苷酸。该设计将促使工程菌在肠道内低氧环境下能够高效表达FGF19,同时分泌至细胞外面,有效接触作用肠道黏膜,工程菌工作模式见图1。
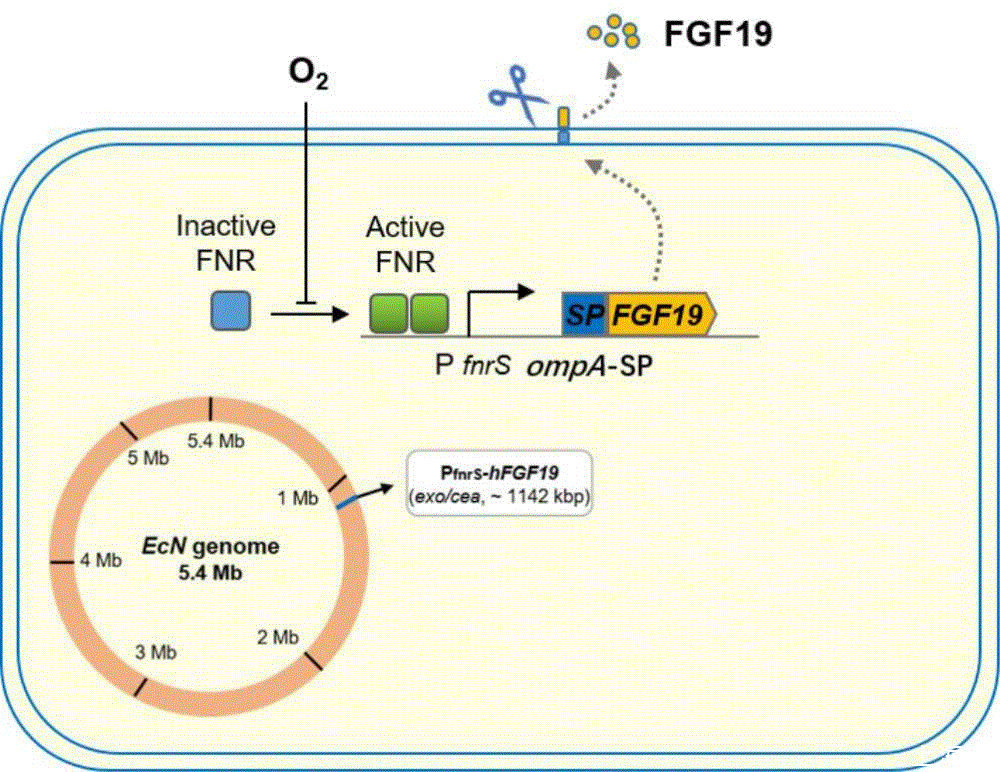
3、工程化大肠杆菌EcN FGF19-01构建步骤
细菌基因编辑采用双质粒系统(pCas,addgene#62225;pTargetF,addgene#62226)。选择EcN基因组的exo/cea基因位点作为编辑插入区域,因为该位点被证明是安全位点,不会诱发基因毒性和不影响细菌自身生存。首先把pCas质粒通过电转导入EcN感受态细胞,筛选阳性菌株,命名为EcN Cas9+;然后构建带有exo/cea-sgRNA、上下同源臂和PfnrS-FGF19表达框序列的pTargetF-exo/cea-sgRNA-FGF19重组质粒;步骤如下:利用gRNA设计网站工具(https://www.genscript.com/gRNA-design-tool.html),针对EcN基因组的exo/cea基因位点序列设计得到20 bp的gRNA序列(GGAACTACATTAGGTATCTG),然后设计带有SpeI/PstI双酶切位点的引物exo/cea-sgRNA-F和exo/cea-sgRNA-R,以pTargetF质粒为模版,PCR扩增得到exo/cea-sgRNA序列,然后插入pTargetF质粒得到pTargetF-exo/cea-sgRNA重组质粒;委托铂尚生物技术(上海)有限公司合成上述1020 bp PfnrS-FGF19表达框核苷酸序列;设计引物,PCR扩增exo/cea位点的上游和下游同源臂序列,命名为exo/cea-LHA、exo/cea-RHA,长度分别为1040 bp、1010 bp;通过Overlap-PCR将所述1020 bpPfnrS-FGF19表达框核苷酸序列和exo/cea-LHA、exo/cea-RHA序列进行连接,再通过BglII/XhoI双酶切、连接插入至重组质粒pTargetF-exo/cea-sgRNA,最终得到重组质粒pTargetF-exo/cea-sgRNA-FGF19。
进一步将重组质粒pTargetF-exo/cea-sgRNA-FGF19电转化至EcN Cas9+感受态菌株中;通过在LB平皿固体培养基中添加10 mM的阿拉伯糖和Spe、Kan双抗性进行菌株筛选,阳性菌株,经过基因编辑后,然后从LB平皿中挑取单菌落;然后通过PCR鉴定阳性菌株,以及测序筛选阳性突变菌株。
最后,将得到的编辑成功的阳性菌株进行pCas和pTargetF-exo/cea-sgRNA-FGF19质粒消除。将细菌接种至1.5 mL含有卡那霉素(50μg/mL)和IPTG(0.5 mM)的LB培养基中,孵育8-16h,然后稀释,涂布至含有卡那霉素(50μg/mL)平板上。然后挑单克隆菌株进行PCR鉴定,筛选消除了pTargetF-exo/cea-sgRNA-FGF19质粒的阳性菌株。最后将菌株接种至无抗性的LB培养基,37度培养过夜,然后稀释,涂布至无抗性平板上。然后挑单克隆菌株进行PCR鉴定。最终将得到编辑成功且不带pCas和pTargetF-exo/cea-sgRNA-FGF19质粒的阳性工程化大肠杆菌株,并命名为EcN FGF19-01;将野生型菌株命名为EcN WT。
4、工程菌EcN FGF19-01和野生型菌株EcN WT的生长曲线测定
将EcN FGF19-01和EcN WT单克隆菌株培养在LB培养基中过夜,于第二天早上,分别按照1∶100比例接种,然后分别在0、2、4、6、8、10和12h时测定OD600值,并绘制生长曲线。结果显示,EcN FGF19-01和EcN WT菌株生长曲线无显著差异。
5、RNA提取及实时定量荧光PCR
总RNA抽提按照Trizol试剂(Invitrogin)说明书操作步骤进行,并用RNA纯化试剂盒TURBO DNA-freeTM Kit(AM1907,Applied Biosystems)对提取的总RNA进行纯化去除DNA,操作参照说明书进行。qRT-PCR反应在实时定量PCR检测系统(EBI,7900)上完成。10μL反应体系为:5μL SYBR Premix、4μL DNA、0.5μL上游引物、0.5μL下游引物。程序为:95°C 3 min,(95°C 20 s、60°C 20 s、72°C 20 s+读板)40个循环,(55°C升温到95°C,每0.5°C读5 s)溶解曲线。用细菌总16S作为内参进行样品间的校正,结果用2-ΔΔCt方法进行计算,检测突变菌株中FGF19的表达。结果显示,在无氧条件下EcN FGF19-01菌株显著高表达FGF19 mRNA。
