量化人类肠道菌种对艰难梭菌长期生长的影响(二)
与基于艰难梭菌(C.difficile)在人类肠道群落中短时间尺度测量推导出的gLV物种间相互作用网络(主要以负相互作用为主)相比,长期生态相互作用推导出的网络显示出较高频率的正相互作用(图1C)。在这一时间尺度上,PV和DP与艰难梭菌之间表现出双向正相互作用,而理论上这可能会导致群落动态的不稳定性(图1D,图S1C,图S2A和图S2B)。相反,EL与艰难梭菌之间表现出输出正相互作用和输入负相互作用。这种拓扑结构可能形成负反馈回路,从而稳定群落动态,并解释了观察到的EL与艰难梭菌之间的稳定共存现象。
然而,经常排斥艰难梭菌的物种(如PC和BT)也显示出与艰难梭菌之间的输出负相互作用和输入正相互作用。这与竞争性排除动态的稳定性相一致(图S2B)。CS和CH在双物种共培养中被艰难梭菌在7次传代后竞争淘汰,并且经常被三物种群落排除(图S1C,图S1F和图S2A),这与来自艰难梭菌的输入负相互作用一致。
为了评估群落中物种共存的程度,我们计算了香农多样性指数的变化(ΔH)(图1E)。含有EL和CA的群落表现出较高的ΔH,而含有BT的群落则表现出最低的ΔH。此外,我们通过计算各时间点之间物种相对丰度的欧几里得距离,量化了群落动态的变异性。较大的欧几里得距离值及其更广的分布范围表明群落不稳定性增加。PV和DP的存在使欧几里得距离增加,与其他物种相比,其双向正相互作用的网络拓扑可能导致群落动态的不稳定性(图1F)。
我们研究了在较长时间尺度和不同环境条件下与艰难梭菌(C.difficile)共存的一部分群落的动态。具体而言,我们将包含CA、EL、BU、DP和PV的双物种群落,与两种不同的艰难梭菌菌株分别在三种不同培养基条件下共培养了341代(图S4A–S4D)。由于艰难梭菌在不同菌株之间具有很大的遗传变异性,研究中选择了一个具有毒素的DSM 27147菌株和一个非毒素的MS001菌株,后者具有更大的基因组和独特的代谢能力。此外,我们通过修改基础培养基降低碳水化合物浓度(降至原来的1/4)或提高氨基酸浓度(增加至原来的2倍)。减少碳水化合物浓度可能通过改变竞争强度和/或某些肠道菌种导致的培养基酸化来影响艰难梭菌的生长;而增加氨基酸浓度可能通过增强Stickland代谢促进艰难梭菌的生长。该代谢途径通过偶联氨基酸的氧化和还原产生有机酸,为能量和生长提供支持。
在大多数群落和营养环境中,艰难梭菌DSM 27147和MS001表现出相似的长期动态(图S4E–S4G)。相比之下,CD-PV和CD-DP的动态在时间上表现出更大的不稳定性,并且在不同营养环境下的变化幅度大于其他群落(图S4E–S4J)。
总之,EL在长时间尺度内促进了艰难梭菌在群落中的稳定共存。相反,PV或DP的存在在不同环境条件下引发了群落动态的不稳定性。这些动态总体上与其推导的相互作用网络拓扑一致。
资源受限的环境促进了艰难梭菌与PV的交叉喂养和共存
已有研究表明,人类结肠中约30%的细菌属于拟杆菌属(Bacteroides),其中PV、BT、BU、B.distasonis、B.fragilis和B.ovatus在个体间的普遍性最高。除此之外,拟杆菌属的定植稳定性已被多次验证。尤其是,PV因其较高的定植能力,被视为治疗复发性艰难梭菌感染(rCDI)的潜在活菌疗法候选菌株。研究艰难梭菌与这些肠道微生物中高度丰度且稳定的成员之间的相互作用,可以为揭示影响艰难梭菌定植的因素提供重要见解。
在CD-PV共培养中观察到一个独特现象:营养环境的改变可以在一定时间范围内将群落动态从竞争性排除转变为共存。在高浓度碳水化合物环境下,艰难梭菌在约186–224代时被排除;而在降低碳水化合物浓度的培养基中,艰难梭菌与PV共存了341代(图S4E和S4F)。
为揭示这些条件下驱动共存与竞争性排除的代谢活动,我们对PV和艰难梭菌在两种培养基中的代谢产物进行了外代谢组学分析,通过测量培养液上清液中代谢物的浓度变化(起始时和培养24小时后,见图2A和2B)。在单菌培养中,艰难梭菌利用其司提克兰氏反应(Stickland)代谢能力,消耗了培养基中的多种氨基酸。在低碳水化合物培养基中,PV释放了艰难梭菌利用的84%的代谢物,包括用于Stickland代谢的氨基酸。在PV单菌培养中,这些代谢物在24小时内呈现递增趋势;但在CD-PV共培养中,这些代谢物在约6到12小时后呈现下降趋势,表明它们被艰难梭菌消耗。因此,这些结果支持了PV向艰难梭菌跨物种供给多种代谢物的现象(图2A和图S5)。
相比之下,在高碳水化合物浓度下,预测的跨物种供给较少,艰难梭菌利用的代谢物中仅有12%由PV释放(图2B和图S6)。此外,PV在单菌培养中消耗了艰难梭菌利用的24%的代谢物,包括葡萄糖和肌醇,表明在这种培养基条件下资源竞争占主导地位。在高碳水化合物培养基中,艰难梭菌利用的代谢物中,有45%也在低碳水化合物培养基中被利用。这表明改变碳水化合物浓度调节了艰难梭菌的代谢生态位。
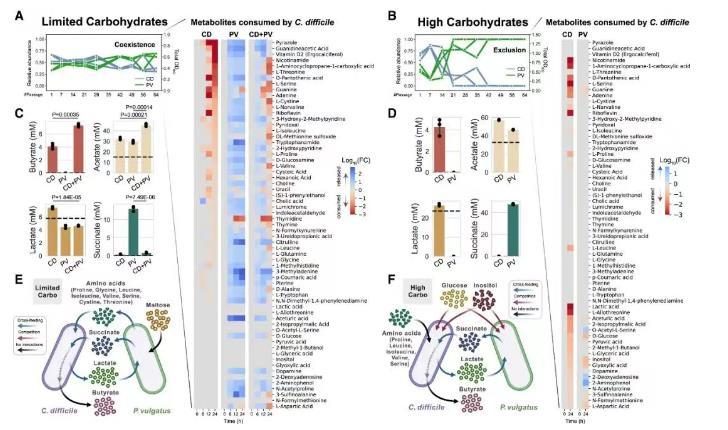
图2|两种营养环境中艰难梭菌和普通拟杆菌的外代谢组学分析
(A和B)艰难梭菌在基础培养基中消耗的代谢物相对于空白培养基(t=0 h)的倍数变化热图,分别在降低碳水化合物浓度的培养基(低碳水化合物培养基,A)和基础培养基(高碳水化合物培养基,B)中展示。完整的代谢组学分析见图S5(低碳水化合物培养基)和图S6(高碳水化合物培养基)。时间变化的丰度测量图来自图S4E和S4F。
(C和D)有机酸在低碳水化合物培养基(C)和高碳水化合物培养基(D)中的定量分析(均值±标准差,n=3)。水平虚线表示空白培养基中检测到的浓度。未配对双侧t检验的p值也已标注。
(E和F)CD-PV共培养中主要代谢活动的示意图,分别在低碳水化合物培养基(E)和高碳水化合物培养基(F)中进行展示。部分图形使用Biorender制作。
相关新闻推荐
1、产脂肪酶地衣芽孢杆菌LD-1302筛选、培养基及产酶条件研究(一)
2、水貂肠道乳酸杆菌RSJ生长曲线及产酸、药敏试验结果(二)
3、滇黄精水提物促进罗伊氏乳杆菌生长增殖和定植的作用机制(三)
