量化人类肠道菌种对艰难梭菌长期生长的影响(三)
通过对其他8种人类肠道细菌在高碳水化合物培养基中的单菌培养进行代谢组学分析,我们发现,在这种环境中,艰难梭菌与肠道细菌之间的潜在交叉喂养总体上较为稀少。具体来说,其他肠道物种释放的代谢物中,只有约3%–15%被艰难梭菌单菌培养利用(图S6G)。在9种肠道细菌中,CS和CH与艰难梭菌的代谢物利用重叠率最高(分别为61%和36%,图S6E和S6G),可能在司提克兰氏反应的氨基酸上与艰难梭菌竞争。这种潜在的资源竞争与它们在与艰难梭菌共培养中的灭绝情况一致(图S1C和S1F),因为CS和CH的生长速率也低于艰难梭菌(图S6H–S6J)。
除了交叉喂养,这种共存还可能通过利用非重叠资源来实现。在高碳水化合物培养基中,艰难梭菌消耗的代谢物中有21%是独特的(图S6B),这表明正交生态位可能使艰难梭菌与某些肠道物种共存。在这些细菌中,艰难梭菌消耗的代谢物种类数量仅次于CS(图S6D),表明艰难梭菌具有灵活而广泛的代谢生态位。
发酵终产物在肠道微生物组的种间相互作用中起重要作用。因此,除了通过液相色谱-质谱联用(LC-MS)测量的广泛代谢物组外,我们还量化了艰难梭菌和PV在生长24小时后培养上清液中丁酸、乳酸、乙酸和琥珀酸的浓度(图2C和2D)。这些发酵终产物在肠道中可达到高浓度,并影响人类健康。例如,丁酸是一种有益代谢物,是结肠细胞的主要能量来源,促进肠道稳态,并已被证明可减少小鼠艰难梭菌感染(CDI)的疾病严重程度。尽管艰难梭菌和PV都产生乙酸,但PV产生琥珀酸,艰难梭菌则产生丁酸。在共培养中,琥珀酸浓度显著低于PV单菌培养,而丁酸浓度显著高于艰难梭菌单菌培养(图2C)。这表明艰难梭菌将PV释放的琥珀酸转化为丁酸。从拟杆菌到艰难梭菌的琥珀酸交叉喂养在小鼠中也被观察到,这表明这种代谢交换在哺乳动物肠道中具有重要意义。此外,艰难梭菌产生乳酸并被PV利用,表明代谢物的双向交换(图2C和2D)。总之,这些数据表明,PV和艰难梭菌能够通过多种代谢物的交换进行相互作用。
除了高碳水化合物浓度环境中资源竞争的增强和代谢物交叉喂养的减少外,PV在单菌培养及与艰难梭菌的共培养中显著降低了培养基的pH值(图S7A)。由于研究表明艰难梭菌的生长在低pH条件下会受到负面影响,15 PV引起的培养基酸化可能促进了竞争性排除的动态。在有限碳水化合物培养基中,未观察到培养基酸化,这与艰难梭菌和PV在该环境中的共存相一致(图2A)。
总体而言,碳水化合物有限的环境促进了代谢物交叉喂养以及艰难梭菌和PV之间的共存(图2E)。在高碳水化合物浓度的环境中,资源竞争可能占主导地位,并导致培养基pH显著降低。因此,在与PV的共培养中,艰难梭菌的生长受到抑制,最终在约第35–42次传代后被排除(图2F)。
在与PV长期共培养后艰难梭菌种群中的关键代谢基因出现单点突变
除了生态交互外,艰难梭菌与PV的长期共存可能会导致艰难梭菌的进化适应,这对人体肠道可能具有重要意义。为识别在有限碳水化合物培养基中长期共培养后CD-PV群体中出现的突变,我们对第35、49和64次传代(即第186、261和341代)的CD-PV群体进行了全基因组测序(whole-genome sequencing,WGS)。结果在艰难梭菌群体中检测到多个非同义单点突变,突变频率约为14%至97%(图S8A;表S5)。由于突变和遗传漂变的随机性,重复实验的群体未显示完全相同的进化动态。
检测到的非同义突变基因的预测功能与毒力、膜蛋白、ATP结合盒(ABC)转运蛋白和代谢(如磷酸转移酶系统(phosphotransferase system,PTS)和Stickland代谢调控因子)相关。这些基因中的一些在来自健康个体和感染艰难梭菌疾病(CDI)患者的18株分离株中表现出氨基酸变异(图S8B),表明这些序列变异可能对进化适应有贡献。此外,我们还检测到PV基因组中从第35次到第64次传代出现的多处突变,突变频率约为18%至46%(表S5)。
在艰难梭菌群体中的所有突变中,基因206(G533W)和prdR(A341V)在所有测量的传代中频率都显著增加,并在64次传代后显示出最高频率(图S8A;表S5)。基因206编码一种PTS糖运输子单元IIA,这一基因突变出现在CD-PV共培养的所有三次重复实验中,并在所有突变中显示出最高频率(传代35约56%,传代49可达97%)。相比之下,prdR突变只出现在第49次传代的CD-PV共培养实验的一次重复中(约15%),并在第64次传代达到约47%。这一现象与基因206在18株自然分离株中氨基酸序列显示出变异相关,而prdR的序列高度保守(图S8B)。因此,prdR的突变可能仅在特定条件下(如基因206突变背景下)发生。prdR是一个核心代谢调节因子,控制丙氨酸和甘氨酸的优先利用,通过Stickland反应产生能量,这对于艰难梭菌的生长和定植至关重要。在丙氨酸存在的情况下,prdR激活编码丙氨酸还原酶的基因的转录,并负调节编码甘氨酸还原酶的基因。以前的研究表明,prdR的缺失会影响艰难梭菌毒素的产生。
为了进一步表征这些单点突变,我们从CD-PV群体最后一次传代中分离出一株携带基因206和prdR两处突变的艰难梭菌菌株(图3A)。WGS验证了这两处突变仅出现在所分离的艰难梭菌菌株(演化菌株)中,而未出现在祖先株中的甘油库存菌株(表S6和S7)。在有限碳水化合物培养基中与PV共培养341代后,演化艰难梭菌菌株趋于接近于等比例,而祖先株的丰度则远离等比例(基于Mann-Kendall检验的显著趋势,图S7B和S7C)。因此,艰难梭菌菌株与PV共存的稳定性高于祖先株。
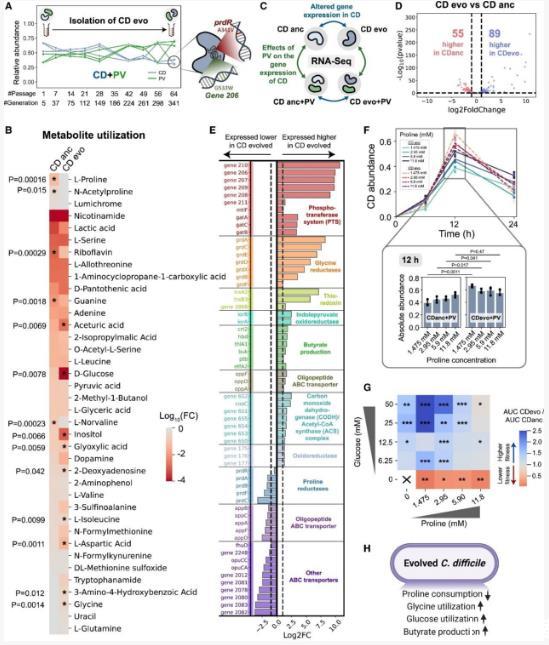
图3|艰难梭菌获得了长期与PV共培养过程中,改变其代谢生态位的进化
(A)艰难梭菌在与PV共培养的限碳环境中,经过341代分离出来。社区动态的图表来自于图S4F。
(B)祖代和进化代艰难梭菌株的代谢利用量对数变换的折叠变化热图,与空白培养基相比(n=3)。与空白培养基相比显著高浓度的代谢物显示在图中(两侧t检验,方差不齐)。星号表示在代谢物释放量之间有显著差异(两侧t检验,p值<0.05)。
(C)全基因组转录组剖析实验的示意图。
(D)进化代艰难梭菌株与祖代株转录折叠变化的火山图。每个数据点代表一个单独的基因。虚线表示2倍变化,水平虚线表示由DESeq2的Wald检验计算的统计显著性阈值(贝南明-霍奇伯格多重检验校正,BH调整p值=0.05)。
(E)选定基因在进化代艰难梭菌株中高表达和低表达的对数变换折叠变化。垂直虚线表示2倍变化。
(F)当在不同脯氨酸浓度下与PV共培养时,艰难梭菌的丰度。条形图显示了12小时时艰难梭菌的丰度(均值±SD,n=3)。两侧未配对t检验p值显示在图中。
(G)进化代艰难梭菌株与祖代株在不同葡萄糖和脯氨酸浓度下的适应性热图。适应性比较通过单培养生长下的曲线下面积(AUC)比率量化(图S11)。星号表示未配对t检验之间的显著性p值。?p<0.05,??p<0.01,???p<0.001。×符号表示未生长。具体p值见图S11。
(H)进化代艰难梭菌株代谢改变的示意图。
