lmo1508/lmo1509基因缺失对单增李斯特菌生长曲线、抗氧化应激能力的影响(三)
2 结果与分析
2.1 gsh-px报告质粒的构建
利用生物信息学分析获得gsh-px基因上游的启动子序列,以10403S基因组和质粒pFL251为模板分别扩增出508 bp的gsh-px启动子Pgsh-px和737 bp的gfp片段。通过SOE-PCR将Pgsh-px和gfp进行融合获得1 245 bp的Pgsh-px-gfp片段。通过重组的方法将Pgsh-px-gfp与pERL3载体连接并构建gsh-px报告质粒pFL516。将连接产物用热激法转化至大肠杆菌DH5α感受态细胞中,挑取单克隆并使用pFL516 A/D引物对进行PCR鉴定及测序验证,经凝胶电泳获得1 245 bp的条带(图1),符合预期大小且测序正确,说明gsh-px报告质粒成功构建。
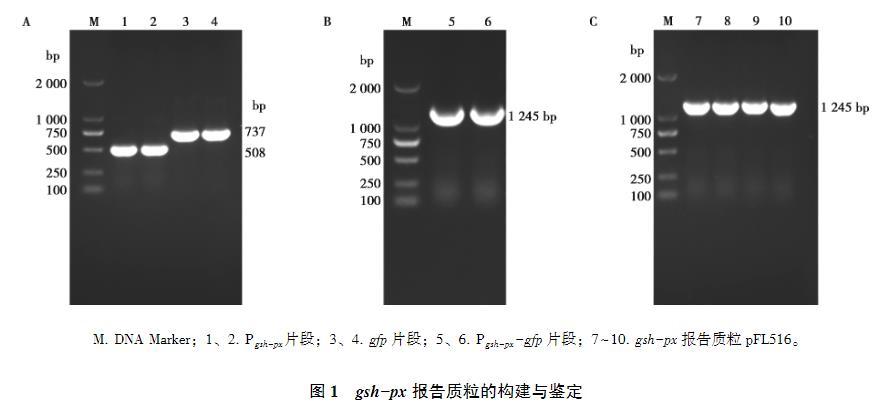
图1 gsh-px报告质粒的构建与鉴定
2.2 荧光蛋白表达菌株的构建
提取gsh-px报告系统pFL516质粒,采用电转化将pFL516电转至LM菌株10403S感受态细胞中构建荧光蛋白表达菌株10403S-pFL516,挑取单克隆并使用pFL516 A/D引物对进行PCR鉴定,获得pFL516目的片段(图2),与预期结果一致,表明LM荧光蛋白表达菌株构建成功。
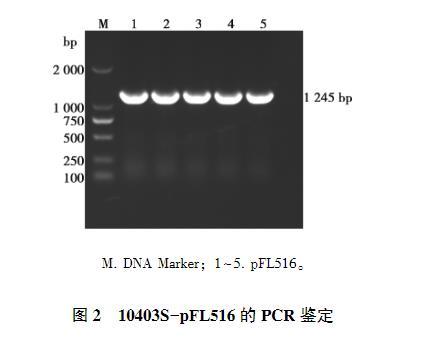
M. DNA Marker;1~5. pFL516。
图2 10403S-pFL516的PCR鉴定
2.3 荧光蛋白表达情况
在荧光显微镜下,携带报告质粒的10403S-pFL516发出绿色荧光,而10403S无荧光(图3 A);使用酶标仪对10403S-pFL516和10403S的荧光值进行测定,10403S-pFL516的荧光强度高达656 874 RFU,而10403S的荧光值只有9 465 RFU(图3 B),说明该报告质粒可在LM中正常表达。
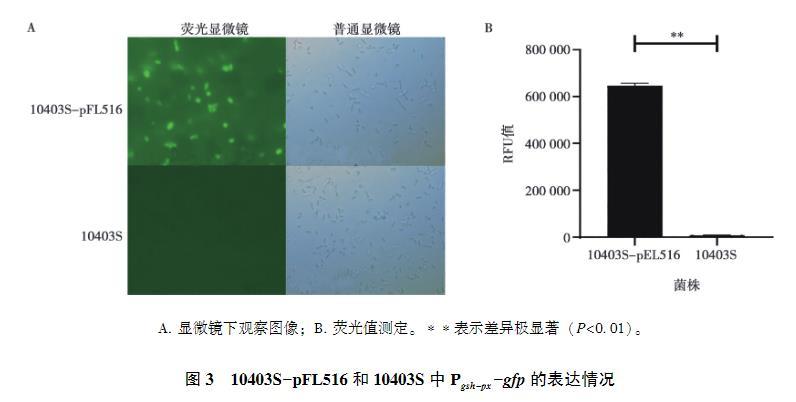
A. 显微镜下观察图像;B. 荧光值测定。表示差异极显著(P<0.01)。
图3 10403S-pFL516和10403S中Pgsh-px-gfp的表达情况
2.4 TCS缺失株中gsh-px报告系统的鉴定
将pFL516电转入LM各TCS缺失株感受态中,涂布于EM抗性的BHI平板,挑取单菌落用pFL516 A/D引物鉴定,结果显示报告质粒已成功电转入TCS缺失株中(图4)。

图4 TCS缺失株中pFL516的PCR鉴定
2.5 TCS缺失株中荧光值的检测
将gsh-px的报告质粒pFL516电转入各TCS缺失株感受态中,通过检测携带pFL516报告质粒的各TCS缺失株的荧光值发现:在已敲除TCS的LM菌株中,lmo0050/lmo0051、lmo1060/lmo1061、lmo1508/lmo1509、lmo1947/lmo1948、lmo2010/lmo2011、lmo2678/lmo2679、lmo2582/lmo2583这7个TCS的缺失使得其荧光值相对于亲本株10403S-pFL516极显著升高;而lmo1021/lmo2022、lmo1377/lmo1378、lmo0691/lmo0692这3个TCS的缺失使得荧光值相对于亲本株10403S-pFL516显著降低;lmo1172/lmo1173、lmo2514/lmo2515、lmo1741/lmo1742这3个TCS的缺失使得荧光值相对于亲本株10403S-pFL516极显著降低;lmo2500/lmo2501的缺失使得其荧光值相对于亲本株10403S-pFL516无显著差异(图5)。荧光值越大转录水平越高,反之则表示转录表达水平越低,说明lmo0050/lmo0051、lmo1060/lmo1061等7个TCS双元调控系统的缺失导致gsh-px基因转录水平上调,它们与gsh-px启动子之间存在负调控关系;lmo1021/lmo2022、lmo1377/lmo1378等6个TCS的缺失则导致gsh-px基因转录水平下调,它们与gsh-px启动子之间存在正调控关系。
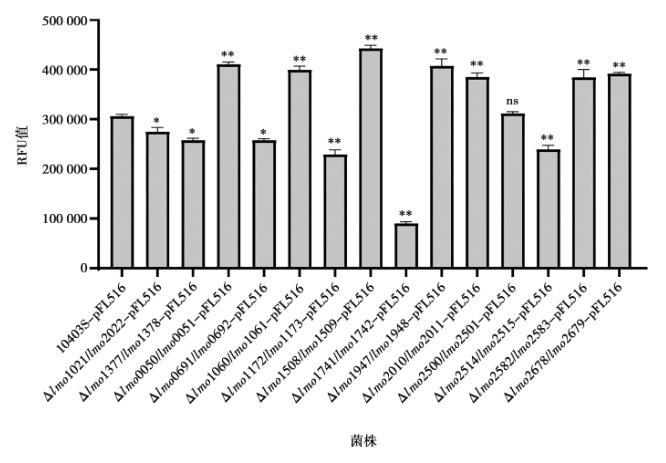
注:与对照组(10403S-pFL516)相比,ns表示差异不显著(P>0.05),表示差异显著(P < 0.05),*表示差异极显著(P < 0.01)。下同。
图5 不同TCS缺失株中gsh-px报告基因的表达水平
相关新闻推荐
1、枯草芽孢杆菌BC80-6发酵培养基、生长条件及对烟草根黑腐病菌生防作用(一)
2、丹毒败血症:猪红斑丹毒丝菌形态、生化特征、鉴定及药敏试验——摘要、材料与方法
