内酯型槐糖脂对白色念珠菌生长抑制和生物膜形成的影响(二)
2.3LSL对白色念珠菌细胞微观结构的影响
使用SEM观察LSL处理不同时间后白色念珠菌细胞微观结构的变化。处理组取培养好的对数生长期白色念珠菌菌液(菌浓已调整为1 x106CFU/mL),以2.0%(v/v)接种量将其接种到LSL浓度为MIC值的50mL液体培养基中,对照组取上述白色念珠菌菌液接种于等体积未添加LSL的液体培养基中。分别在培养2、4、8、12h时各取出3 mL培养物于6000r/min(离心半径9.25cm)离心10 min收集菌泥,PBS溶液洗涤3次后使用2.5%戊二醛在4℃冰箱中固定12h,PBS溶液洗涤3次后离心并分别以乙醇梯度脱水(50%,70%,80%,90%,100%),真空条件下干燥,喷金,SEM观察并拍照。
2.4LSL对白色念珠菌细胞膜通透性和完整性的影响
使用CLSM观察LSL处理前后白色念珠菌细胞膜通透性和完整性的变化。使用荧光探针羧基荧光素双乙酸酯(FDA)和碘化丙啶(PI)标记和区分活细胞与死细胞。分别在培养2、4和12h时取按2.3步骤制备的处理组和对照组细菌悬液各500μL,4℃下6000r/min离心10min后收集菌体,等体积PBS溶液重悬后加入cFDA使其终浓度为100μmol/L,避光反应10min后加入PI使其终浓度为30μmol/L,避光反应10min后10000r/min离心2min收集菌体,PBS溶液重复洗涤3次,最终将菌体悬浮于500μL PBS中。吸取3.0μL菌液置于CLSM下观察并拍照。
2.5LSL对白色念珠菌胞内ATP含量的影响
通过测定胞内ATP浓度的变化,分析LSL对白色念珠菌细胞膜通透性的影响。按2.3步骤制备处理组和对照组细菌悬液,分别在培养不同时间后取样,将上述样品在10000r/min下离心1min后分别收集菌体和上清液置于冰上备用。取菌体按照ATP测定试剂盒说明书处理样品并测定和计算样品胞内ATP含量。每组测定实验重复3次,每次测定设置3个平行。
2.6LSL对白色念珠菌胞外紫外吸收物质含量的影响
取2.5中制备所得上清液样品,使用酶标仪分别测定其在波长为260nm下的吸光度值,评估LSL处理不同时间后白色念珠菌胞外紫外吸收物质(主要为核酸和蛋白质等)浓度的变化。
2.7 LSL对白色念珠菌生物膜形成的影响
采用结晶紫染色法评估LSL对白色念珠菌生物膜形成的抑制作用。取100mu L培养至对数生长期的白色念珠菌菌液(菌浓调整为1x106CFU/mL)与等体积LSL溶液混合,使LSL终浓度为0~20mg/mL。37℃下共孵育24h后将液体轻轻吸出,使用PBS溶液清洗3次以去除浮游细胞,其余贴壁细胞使用99%甲醇固定15 min,之后将甲醇吸出并静置,待甲醇完全挥发后加人100μL0.1%结晶紫染色5min。染色结束后将染液吸出并使用PBS清洗3次,最后加入100μL 95%乙醇溶解细胞中结合的结晶紫。以未经LSL处理菌液为对照组,以波长600nm处测定的吸光度为生物膜质量的量度,参照生物膜抑制率公式计算LSL对白色念珠菌的生物膜抑制率。每组实验重复3次。生物膜抑制率(%)=[1-(实验组A600÷对照组A600)]x 100%。
2.8数据处理与分析
采用GraphPad Prism 8.0软件对数据进行统计和绘图。结果以平均值±标准偏差(x±s)表示,多组比较采用单因素方差分析,P<0.05为差异有统计学意义。
3、结果
3.1、LSL对白色念珠菌MIC和MFC
实验结果显示,当LSL浓度为6.00mg/mL时,最终菌液与初始菌液的A_{600}差值稳定在5%以内;当LSL浓度为18.00 mg/mL时,平板上无菌落生长。因此,LSL对白色念珠菌的MIC为6.00mg/mL,MFC为18.00mg/mL。如无特殊说明,后续实验中所使用的LSL处理浓度均为LSL对白色念珠菌的MIC值。
3.2、LSL对白色念珠菌生长的影响
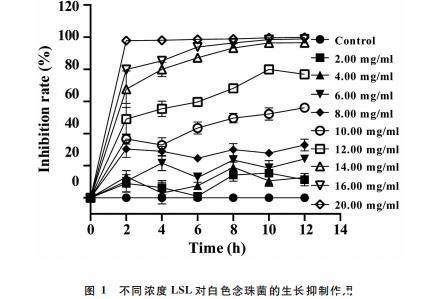
图1为以12h为一生长周期绘制所得的LSL对白色念珠菌浮游细胞的时间-抑菌率变化曲线。可以发现,LSL对白色念珠菌浮游细胞的生长抑制效应快速且显著,且抑制效果随LSL浓度的增加而提升。其中,0~2h内的抑菌率增速最快,2h后8.00mg/mL的LSL即可发挥稳定的抑菌效果;当浓度高于8.00 mg/mL时,LSL还表现出明显的杀菌和溶菌作用,此结果与LSL对白色念珠菌的MIC和MFC测定结果一致。
3.3、LSL对白色念珠菌细胞微观结构的影响

使用SEM考察LSL对白色念珠菌细胞微观结构的影响。最小抑菌浓度的LSL与白色念珠菌相互作用2、4、8、12h后的菌体微观形态如图2所示。未经LSL处理的空白对照菌体表面光滑,形态完整且饱满,细胞壁边缘清晰,界限明显,菌体呈椭球状形态(图2A);LSL处理2h后大部分菌体形态完整,少量细胞形态发生改变,表现在菌体出现凹陷、皱缩和塌陷现象,部分内容物外泄(图2B);LSL处理4h后菌体皱缩现象更加明显,少量菌体出现破损现象(图2C);LSL处理8h后,部分细胞失去完整形态,菌体破损严重呈“爆破”状,且内容物外泄产生的粘性使破损细胞聚集在一起,细胞间界限不再明显(图2D);LSL处理12h后,所有细胞均变形且严重破损,菌体因被部分溶解而黏连在一起聚集成团(图2E)。LSL处理不同时间后白色念珠菌细胞的微观形态变化表明,LSL具有很强的群体生长抑制作用,菌体细胞壁和细胞膜的完整性均遭到了不同程度的破坏。
相关新闻推荐
1、鸭瘟病毒基因缺失株rDEV-ΔVP26生长曲线、蚀斑面积及免疫原性分析(二)
