棘孢木霉TCS007菌株的固态发酵条件、次生代谢产物产量影响因素(二)
1.2试验方法
1.2.1菌株活化培养
TCS007菌株活化:从解冻的甘油管中取10μL TCS007菌株菌液,涂布于PDA平板,于28℃倒置暗培养5 d后,在无菌环境下用直径8 mm的无菌打孔器切取菌饼,接种至PDA平板中央,于28℃倒置暗培养5 d,备用。
植物病原真菌活化:用无菌接种针从解冻的冷冻管中挑取菌丝,接种于PDA平板上,于26℃倒置暗培养7 d,备用。
1.2.2种子液制备
在无菌环境下,用无菌水冲洗长至培养皿直径2/3的TCS007菌株,经无菌纱布过滤菌丝,获得TCS007菌株的分生孢子悬浮液。采用µCount3D立体计数仪测定孢子含量,用无菌水将孢子浓度调节至1×107个/mL种子液,备用。
1.2.3固态发酵方法及粗提发酵产物产量测定
1.2.3.1固态发酵法
称取72 g大米,倒入300 mL三角瓶中,加入48 mL蒸馏水,充分搅拌,封口灭菌60 min后,在无菌环境下接入1 mL TCS007菌株种子液,置于28℃霉菌培养箱中黑暗培养21 d。
1.2.3.2浅盘发酵法
称取216 g大米和7.56 g黄豆粉,倒入500 mL三角瓶中,加入141 mL蒸馏水,充分搅拌,封口灭菌60 min后,在无菌环境下接入3 mL TCS007菌株种子液,置于28℃霉菌培养箱中黑暗培养7 d后,在无菌条件下转移到浅盘(21 cm×33 cm×4 cm)中,用保鲜膜密封,并在上方用细针均匀开孔透气。
1.2.3.3粗提发酵产物的制备及产量计算
将棘孢木霉TCS007菌株发酵物与乙酸乙酯等体积互溶萃取3次,并充分搅拌合并萃取液后静置24 h后抽滤;得到的萃取液再经过0.22μm的微孔滤膜过滤3次,加入无水硫酸钠干燥,旋蒸减压浓缩至干;用乙酸乙酯复溶后收集于离心管中,待溶剂挥发后即得到TCS007菌株的粗提发酵产物,称量备用。在每组处理中,保持固态发酵培养基中的大米质量为72 g不变,因此后文提到的TCS007菌株粗提发酵产物产量(单位g)均为72 g大米前提下的产量。
1.2.4 TCS007菌株固态发酵条件单因素优化试验
1.2.4.1培养基组分优化
在初始固态发酵培养基的基础上,分别利用1%速效碳、氮源筛选法和递进法进行固态培养基单因素优化。试验设置分别为:1)以添加的碳源为唯一变量,分别添加大米质量分数1.0%的蔗糖、果糖、葡萄糖、α-乳糖和甘露醇,其他发酵参数不变,共5个处理组;2)以添加的氮源为唯一变量,分别添加大米质量分数1.0%的尿素、蛋白胨、黄豆粉、硫酸铵和酵母粉,其他发酵参数不变,共5个处理组;3)以添加的无机盐为唯一变量,分别添加大米质量分数1.0%的无水MnSO4、NaCl、MgSO4、CaCl2和FeCl3,设不添加无机盐的对照组,其他发酵参数不变,共6个处理组。上述试验各组处理均重复3次。
1.2.4.2培养条件优化
在初始固态发酵培养基的基础上,发酵条件单因素优化试验设置分别为:1)以加水量为唯一变量,分别加入24、36、48、60和72 mL蒸馏水,其他发酵参数不变,共5个处理组。2)以接种量为唯一变量,分别接入0.5、1.0、1.5、2.0和2.5 mL种子液,其他发酵参数不变,共5个处理组。3)以初始pH为唯一变量,分别用1 mol/L的稀盐酸和1 mol/L的氢氧化钠调节蒸馏水pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0,其他发酵参数不变,共9个处理组。4)以培养时间为唯一变量,分别设定为7、14、21、28、35和42 d,其他发酵参数不变,共6个处理。5)以培养温度为唯一变量,分别将培养基置于22、25、28、31和34℃培养箱中黑暗培养,其他发酵参数不变,共5个处理。6)以光照周期为唯一变量,将培养箱的光照周期分别调节为24 h光照/0 h黑暗、18 h光照/6 h黑暗、12 h光照/12 h黑暗、6 h光照/18 h黑暗以及0 h光照/24 h黑暗,其他发酵参数不变,共5个处理。上述试验各组处理均重复3次。
1.2.5响应面优化试验设计
1.2.5.1 Plackett-Burman设计
以单因素优化试验结果为基础,综合考虑发酵培养基和发酵条件对TCS007菌株粗提发酵产物产量的影响,选择8个影响显著的因素。根据Placket-Burman设计法,采用软件Design Expert 10针对选出的8个因素进行试验设计,以TCS007菌株粗提发酵产物产量为响应量,从A1-培养时间(7~42 d)、B1-初始pH(3.0~11.0)、C1-培养温度(22~34℃)、D1-光照周期(0~24 h光照)、E1-加水量(24~72 mL)、F1-接种量(0.5~2.5 mL)、G1-葡萄糖添加量(1.0%~5.0%)和H1-黄豆粉添加量(1.0%~5.0%)8个因素中确定各因素对粗提发酵产物产量影响的显著性,筛选关键因子。试验中每个因素取2个水平,即高水平“+1”和低水平“−1”(表1)。
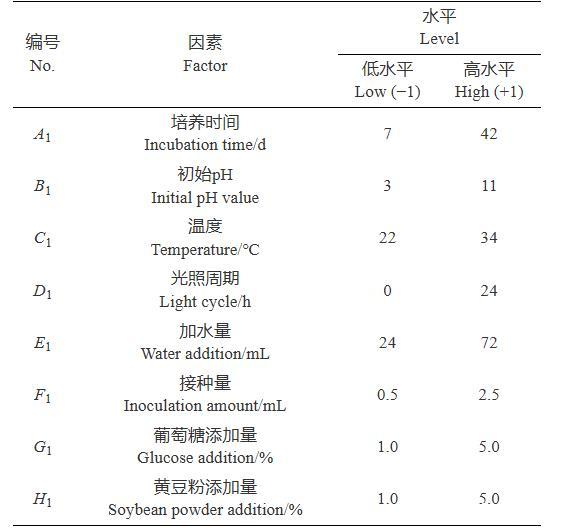
表1 Placket-Burman设计变量与水平
1.2.5.2最陡爬坡设计
基于培养基和培养条件关键因子试验筛选结果,分别从以上因素中筛选出3个最关键的影响因子,设计最陡爬坡试验。根据模型中各变量的系数,确定关键因素的爬坡方向和步长,确定关键因素的最优范围,以所得的TCS007菌株粗提发酵产物产量最高点为中心,组合设计试验的中心点。
1.2.5.3关键因素中心组合试验
采用Box-Behnken响应曲面法设计3因子3水平中心组合试验(表2),对关键因素进行优化,响应因子Y2为TCS007菌株粗提发酵产物产量,分析试验结果,预测棘孢木霉TCS007菌株粗提发酵产物产量达到最大值时所对应的关键因子参数。
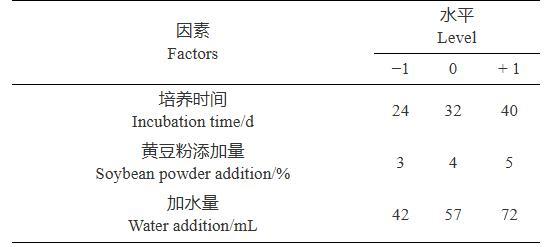
表2 Box-Behnken设计变量与水平
1.2.6优化后固态发酵产物的制备
将采用最优发酵培养基及最优发酵条件所得的TCS007菌株固态发酵产物与溶剂乙酸乙酯等体积互溶萃取3次,合并萃取液,抽滤;先加入无水硫酸钠进行干燥,再旋蒸浓缩至干;用乙酸乙酯复溶后收集于离心管中,待溶剂挥发完即得到TCS007菌株粗提发酵产物,称量备用。
1.2.7粗提发酵产物的抑菌活性测定
采用菌丝生长速率法测定。先用DMF将TCS007菌株粗提发酵产物配制成10 g/L的母液,再用无菌水梯度稀释至500 mg/L。吸取12 mL药液,加入灭菌后的PDA培养基(108 mL)中,充分摇匀后倒入直径为90 mm的培养皿,制成药剂最终质量浓度为50 mg/L的含药PDA平板。同时配制啶酰菌胺最终质量浓度为10 mg/L的含药平板,作为阳性对照。在无菌条件下,于预培养好的各植物病原真菌菌落边缘打取直径8 mm的菌饼,倒置接种于各组PDA平板中央,于培养箱中(26±1)℃条件下倒置培养。待菌落生长至培养皿的2/3时,采用十字交叉法测量菌落直径,各处理重复3次,取平均值,按(1)式计算粗提发酵产物对菌丝生长的抑制率(Im,%)。
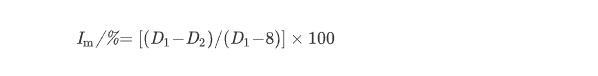
式中,D1:空白对照平板中形成的菌落直径,mm;D2:供试含药平板中形成的菌落直径,mm。
1.2.8粗提发酵产物对病原菌菌核形成与萌发的影响
菌核的形成:在无菌条件下制备含EC50浓度TCS007菌株粗提发酵产物的PDA平板,以空白PDA为对照。待培养基冷却干燥后,于预培养好的油菜菌核病菌菌落边缘打取直径8 mm的菌饼,接种于PDA平板中央,于26℃的恒温培养箱中倒置培养15 d后,对培养皿内菌核的分布及色泽进行观察,并统计各皿内的菌核数量。
菌核的萌发:从正常培养的培养皿中取出大小相同的油菜菌核病菌菌核,对其进行表面消毒,并用EC50浓度的TCS007菌株粗提发酵产物浸泡30 min,每次30粒。浸泡后取出菌核,干燥后移至空白PDA平板中,置于恒温培养箱中(26±1)℃下培养,每12 h对观察1次,并统计菌核萌发的数量,以未浸泡处理的菌核为对照。按(2)式计算粗提发酵产物对菌核萌发的抑制率(Is,%)。
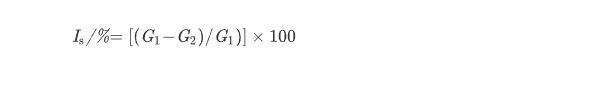
式中,G1:空白对照平板中菌核的萌发数,粒;G2:供试含药平板中菌核的萌发数,粒。
1.3数据统计分析
单因素试验采用SPSS 26软件进行方差分析(analysis of variance,ANOVA),并对方差分析结果进行多重检验(P<0.05),通过Graphpad prism 9软件进行绘图。响应曲面法试验采用Design-Expert 10软件进行数据相关分析。
相关新闻推荐
2、Biosense微生物生长动态监测系统优化哈茨木霉菌生长条件研究方案
3、微生物动态监测系统揭示XO-LPO系统在婴儿口腔微生物群中的抗菌作用
