白马耳组织成纤维细胞体外培养、冷冻前及复苏后存活率、生长曲线绘制(二)
1.2.3乌珠穆沁白马耳组织成纤维细胞冻存前及复苏后存活率测定
当细胞生长状态良好时,按照1.2.1中细胞传代方法得到细胞悬液,通过计数得到细胞总数。取40μl有2.0x 10个细胞的细胞悬液,按照台盼蓝染色计数说明书的染色比例加入10μl已过滤的台盼蓝染液,混匀静置7min(刘刚等2013),在显微镜下观察并统计死细胞数目(死细胞呈蓝色),将其余细胞在液氮中冻存保存1个月后解冻,离心后获得细胞沉淀,加入5ml培养液制得细胞悬液,并按上述染色方法进行染色,计数统计细胞总数及死细胞数。通过统计得到细胞冻存前、复苏后细胞总数与死细胞数目,并根据以下公式计算得到冻存前、复苏后的细胞存活率:细胞存活率=100%[(细胞总数-死细胞数)/细胞总数]。
1.2.4乌珠穆沁白马耳组织成纤维细胞的生长曲线绘制
当细胞生长状态良好时,按1.2.1中细胞传代方法处理细胞以得到细胞悬液,统计细胞总数。取2.4x105个细胞,用24ml培养液混匀后制成细胞悬液。24孔细胞培养板每孔接种1.0x104个细胞,每3孔细胞为一组,共8组,将24孔细胞培养板置于37℃5%CO2培养箱培养。细胞培养24h后每天相同时间统一计数一组细胞的数目,通过计算得出对应生长天数的细胞总数:细胞总数=(细胞数/体积)x总体积x稀释倍数。按相同方法计数8d并统计数据。根据计算得到第1至第8天对应的细胞总数,Biosense微生物生长动态监测系统自动绘制细胞生长曲线图。依据以下公式计算乌珠穆沁白马耳组织成纤维细胞群体倍增时间:D_{T}=tleft[lg 2/left(lg N_{t}-lg N_{0}right)right],式中,D_{T}为细胞倍增时间,t细胞培养时间,Nt细胞培养t时的细胞数目,N0细胞开始进入对数生长期第1天的细胞数;依据以下公式计算乌珠穆沁白马耳组织成纤维细胞群体倍增次数:X=(lgN2-lgN1)/lg2,式中,N1细胞接种时的细胞数目,N2细胞生长至对数期末时的数目。
通过测定不同时间乌珠穆沁白马耳组织成纤维细胞的数量,得到细胞总数与时间的关系,据此绘制出细胞的生长曲线图,实验重复3次。根据实验需要绘制每隔3代的细胞生长曲线图(Li et al.2020)。
1.2.5乌珠穆沁白马耳组织成纤维细胞的贴壁率测定
本实验对乌珠穆沁白马耳组织成纤维细胞进行细胞贴壁率测定,以确定传代的成纤维细胞生长、增殖状态。在细胞生长状态良好时,根据1.2.1中细胞传代方法对细胞进行处理,得到细胞沉淀。1ml培养液充分混匀细胞,统计细胞总数。6孔细胞培养板每孔铺板处理后加入2ml培养液,均匀接种2x105个细胞,重复3孔,于37℃5%CO2培养箱培养。分别在细胞培养6h、12h、24h时进行未贴壁细胞数目统计。轻晃细胞培养板后均匀吸取100μl培养液,利用血球计数板重复计数3次,按以下公式计算得细胞贴壁率,贴壁率=100%[(接种细胞数-未贴壁细胞数)/接种细胞数]。
1.2.6乌珠穆沁白马耳组织成纤维细胞染色体核型
选取处于生长对数期的细胞,每1ml原细胞培养液中添加5μl秋水仙素(20mg/L),每瓶中加入25μl秋水仙素并置于37℃5%CO2培养箱中处理2.5h使细胞停在分裂中期(郭晶营等2018)。秋水仙素处理细胞结束后,弃掉培养液,按1.2.1中细胞传代方法得到细胞沉淀。加入8mlKCl溶液(0.075mol/L)重悬细胞沉淀,充分混匀后将离心管放入37℃恒温水浴锅中低渗40min。在低渗结束前1min加入1ml提前预冷的固定液(甲醛与冰乙酸体积比为3:1)进行预固定。预固定结束后离心(1000r/min,10min)收集细胞沉淀。随后在离心管中加入8ml已预冷的固定液重悬细胞沉淀,轻轻颠倒混匀后置于37℃恒温水浴锅中固定30min,离心(1000r/min,10min)得到细胞沉淀。该步骤重复3次。得到细胞沉淀后根据细胞量加入300~500μl固定液重悬细胞沉淀,吹打混匀。在距已预冷的载玻片垂直距离约为1.6m处使细胞悬液均匀滴落,再把载玻片放入烘箱中70℃烘干2h,室温冷却或室温干燥12h。使用Giemsa染液(2.5mlGiemsa母液溶于47.5ml超纯水中并过滤)染色10~15 min,冲洗掉载玻片背面浮色,自然晾干后即可在显微镜下观察拍照,统计染色体数目。
2结果
2.1乌珠穆沁白马耳组织成纤维细胞培养形态观察

对雄性(图1a)和雌性(图1b)乌珠穆沁白马耳组织成纤维细胞原代建系培养。雄性耳组织在培养5~6d时沿着组织块附近新长出的纺锤形或三角形细胞,确定为成纤维细胞,也有部分细胞形态为扁平不规则多角形,视为上皮细胞。培养10~12d后,培养瓶中细胞汇合度达到60%且成纤维细胞优势生长,在显微镜下观察细胞间有空隙且呈现漩涡状生长。培养13~15d后,培养瓶中细胞汇合度达到80%以上。雌性耳组织细胞生长速度快于雄性耳组织成纤维细胞,在3d后细胞沿组织块周围长出。雌性耳组织成纤维细胞形态及长势与雄性耳组织成纤维细胞基本相同,因此,后续实验选用成纤维细胞进行细胞传代培养及生物学特性分析。
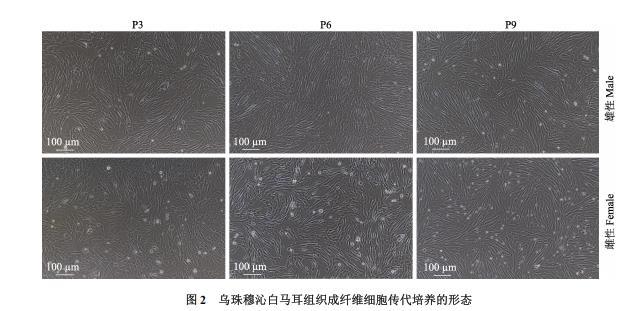
由于成纤维细胞与上皮细胞相比对酶消化液的敏感程度不同,用0.25%胰酶消化液处理,经传代纯化培养后,得到较纯的成纤维细胞。雄性和雌性乌珠穆沁白马耳组织成纤维细胞经过细胞传代培养(图2),均最多培养到80代(P80)。细胞呈现三角形,随着细胞培养代次的增加,细胞生长汇合度达到80%以上需要的时间变长,且细胞形态由立体状三角形形态逐渐变为扁平不规则多边形形态。两种耳组织成纤维细胞经传代培养到后期,雄性耳组织成纤维细胞生长明显优于雌性耳组织成纤维细胞,且雌性耳组织成纤维细胞的形态略微扁平,整体呈现长梭形。
2.2乌珠穆沁白马耳组织成纤维细胞支原体检测
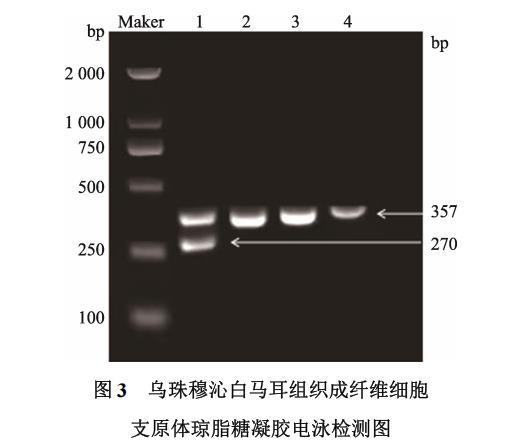
细胞培养过程对环境以及操作步骤的洁净度要求非常高,在细胞培养过程中培养物非常容易因为操作不当等原因而受到污染,从而对之后的实验产生影响,其中,支原体污染较为普遍且不易被发现,因此选择培养的耳组织细胞5代(P5)时进行检测。被检测的雄性、雌性耳组织成纤维细胞均为357bp的单一条带,与支原体检测阴性模板一致(图3),说明雄性、雌性耳组织成纤维细胞培养过程中均未受到支原体的污染。
Maker.2 000 bp DNA分子量标准;1.支原体检测阳性模板;2.支原体检测阴性模板;3.雄性耳组织成纤维细胞;4.雌性耳组织成纤维细胞。
相关新闻推荐
1、豨莶草果实内生细菌分离、鉴定、生长特性、抑菌效果及药敏分析(二)
3、lmo1508/lmo1509基因缺失对单增李斯特菌生长曲线、抗氧化应激能力的影响(四)
