不同条件下裂片石莼水培液的组成成分对耐药弧菌株的抑菌作用(二)
1、材料与方法
1.1实验材料
裂片石莼(Ulva fasciata)购自于广东省汕头市南澳岛(117°02′E,23°42′N),清洗干净后置于人工海水(1 kg海水素溶于28.5 L纯水,盐度为35,海水素购自青岛海之盐水族科技有限公司)中适应性培养2 d。为减少细菌的影响,用抗生素(0.75 mg/L多黏菌素、0.75 mg/L氯霉素、0.9 mg/L新霉素和100 mg/L氨苄青霉素)处理48 h。
为获得不同密度海藻分泌物水培液,称取上述新鲜裂片石莼1.25 g、2.5 g、5 g、10 g和分别置于1 L灭菌后的人工海水中培养(光强为(200±25)μmol/m2/s,光周期为24 h光照:0 h黑暗,25℃下持续曝气)。收集培养1 d和3 d的水培液,通过0.22μm的无菌滤膜过滤后储存在无菌离心管中用于后续实验。
用于分离弧菌的养殖水、沉积物和养殖动物样品分别从浙江省舟山市普陀区朱家尖的白虾、南美白对虾和菲律宾蛤仔3种不同海水养殖场中采集。
药敏纸片:头孢唑林(Cefazolin)、头孢他啶(Ceftazidime)、头孢噻肟(Cefotaxime)、头孢西丁(Cefoxitin)、阿莫西林(Amoxicillin)、氨苄青霉素(Ampicillin)、哌拉西林(Piperacillin)、左氧氟沙星(Levofloxacin Tablets)、美罗培南(Meropenem)、亚胺培南(Imipenem)、环丙沙星(Ciprofloxacin)、阿米卡星(Amikacin)、卡那霉素(Kanamycin)、复方新诺明(Sulfamethoxazole)、庆大霉素(Gentamycin)、氯霉素(Chloramphenicol)、四环素(Tetracycline)、链霉素(Streptomycin),以上全部购自于杭州微生物试剂有限公司。实验药剂邻苯二甲酸单(2-乙基己基)酯(MEHP)、乙缩醛(Acetal)、2-(4-羟基苯)乙醇(p-HPEA)和2,4,6-三溴苯酚(TBP)购于上海阿拉丁生化科技股份有限公司,阿莫西林、氨苄青霉素、头孢唑啉和哌拉西林购于上海源叶生物科技有限公司。
1.2弧菌分离鉴定和耐药性表征
1.2.1弧菌分离鉴定
取10 mL水样转移到40 mL 3%NaCl碱性蛋白胨水(APW)中;取10 g沉积物加入10 mL人工海水并离心(4 000 r/min,10 min);将虾、蛤仔内部组织肉经研磨后加入10 mL蒸馏水离心(4 000 r/min,10 min),将上清液加入到3%NaCl APW中,并在37℃条件下培养24 h获得不同的菌悬液。采用平板划线分离法,将菌悬液用接种环沾取至硫代硫酸盐柠檬酸盐胆汁酸盐蔗糖琼脂(TCBS)和法国科玛嘉培养基(CHROMagar™)上纯化鉴定,经多次划线分离后获得较纯的菌株。将分离菌株按照国家标准方法GB 4789.7-2013进行生化鉴定,并进一步进行DNA提取和16S rDNA测序以鉴定菌种。
1.2.2分离弧菌耐药性表征
参考临床和实验室标准化协会推荐的纸片扩散法检测分离弧菌对各种常见抗生素的耐药性。用无菌棉拭蘸取0.5麦氏浊度(1.0×108 CFU/mL)的菌悬液涂布于Mueller-Hinton琼脂平板表面,再将抗生素药敏纸片贴至平板上,37℃培养24 h后测量抑菌圈的直径大小并判断其药物敏感(sensitive,S)、中介(intermediate,I)及耐药(resistant,R)水平(表1)。
表1弧菌对各抗生素的耐药程度对应的抑菌圈直径
抗生素抑菌圈直径/mm
敏感(S)中介(I)耐药(R)
阿莫西林≥18 14~17≤13
氨苄青霉素≥17 14~16≤13
头孢唑林≥18 15~17≤14
哌拉西林≥21 18~20≤17
美罗培南≥16 14~15≤13
阿米卡星≥17 15~16≤14
氨苄青霉素≥23 15~22≤14
头孢西丁≥18 15~17≤14
卡那霉素≥18 14~17≤13
头孢他啶≥18 15~17≤14
环丙沙星≥21 16~20≤15
左氧氟沙星≥17 14~16≤13
庆大霉素≥15 13~14≤12
亚胺培南≥16 14~15≤13
氯霉素≥18 13~17≤12
链霉素≥15 12~14≤11
复方新诺明≥16 11~15≤10
四环素≥19 15~18≤14
1.3裂片石莼水培液对弧菌的抑制特性
1.3.1裂片石莼水培液对弧菌生长的抑制性能实验
采用改良后的紫外分光光度法检测弧菌的生长情况。将分离的弧菌转移到3%NaCl胰蛋白胨大豆肉汤(TSB)中培养获得菌悬液,通过稀释分别获得1.0×105 CFU/mL和1.0×103 CFU/mL的稀释液,用酶标仪在600 nm处每隔1 h测定吸光度,计算不同弧菌24 h内的生长变化,以无弧菌的3%NaCl TSB溶液作为空白对照,设置3组平行。
分别取9 mL不同密度的裂片石莼水培液于不同试管中作为实验组,加入1 mL弧菌菌悬液(1×105 CFU/mL);阳性组为9 mL的人工海水和1 mL相同浓度的弧菌菌悬液;分别以9 mL的不同密度裂片石莼水培液和人工海水作为实验组和阳性组的阴性对照,并加入1 mL灭菌的3%NaCl TSB溶液。所有组别均设置3个生物学重复,在37℃恒温培养箱中培养12 h测定OD600nm值。弧菌抑制率计算公式为:
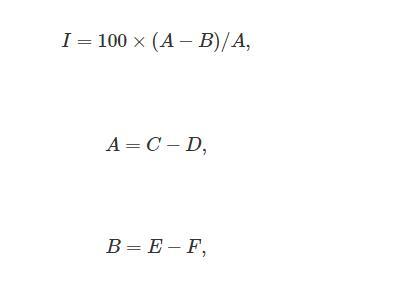
其中I为弧菌抑制率(%),A为对照组弧菌OD600 nm,B为实验组弧菌OD600 nm,C为阳性组OD600 nm,D为阳性组的阴性对照OD600 nm,E为实验组OD600 nm,F为实验组的阴性对照OD600 nm。
1.3.2水培液成分分析
利用固相萃取(Waters OAsis HLB固相萃取柱)将过滤后的裂片石莼水培液和人工海水浓缩到固相小柱中,控制流速低于5 mL/min,每根固相小柱通过2 L样品溶液。加样结束后,使用30 mL超纯水进行淋洗以洗去柱内杂质,继续使用真空泵抽干1 h。取10 mL甲醇加至固相小柱中洗脱,分3~4次进行,最后将洗脱液通过旋转蒸发仪(35℃)浓缩至1 mL,0.22μm过滤除菌后备氮气吹干。加入80μL甲氧铵盐酸盐吡啶溶液(15 mg/mL)涡旋2 min后于37℃下进行90 min肟化反应,再加入80µL双(三甲基硅烷基)三氟乙酰胺(含1%三甲基氯硅烷)衍生试剂,涡旋2 min后于70℃反应1 h,室温静置30 min,采用气相色谱-质谱联用技术(GC-MS)进行检测。
GC-MS分析仪器为8890B-5977B气相色谱质谱联用仪(Agilent,USA),进样量为1µL,分流比为10∶1,色谱柱为DB-5MS毛细管柱。进样口温度260℃,载气为高纯氦气,程序升温60~310℃,质谱仪电子轰击能量70 eV。GC-MS的原始文件通过MassHunter workstation Quantitative Analysis(v10.0.707.0)进行搜库鉴定及数据预处理,将质谱信息与代谢数据库(主要为Fiehn database等商业数据库以及自建的数据库)进行匹配,根据质谱匹配度鉴定代谢物并予以分析。
1.3.3裂片石莼水培液主要成分对弧菌的最小抑菌
采用微量肉汤稀释法检测代谢物对弧菌的最小抑菌浓度(minimum inhibitory concentration,MIC),同时以抗生素阿莫西林、氨苄青霉素、头孢唑啉和哌拉西林对弧菌的MIC为参照。在96孔板中通过二倍稀释法得到不同浓度水培液代谢物和抗生素的稀释液,将100μL稀释液与等量菌悬液(1.0×105 CFU/mL)于37℃培养24 h后,以孔内完全澄清,且浓度最低孔的浓度为MIC。
1.4统计分析
方差分析(ANOVA)用于估计统计学上的显著差异,单样本t检验用于比较样本均值与总体均值之间的差异(IBM SPSS Statistics 26.0),P<0.05为显著差异。使用Origin 2021绘制主成分分析(PCA),将PC1和PC2绘制在一起,根据数据在空间某一方向的投影值的距离进行比较分析,以确定不同培养时间和密度下的海藻水培液的化合物成分差异。
相关新闻推荐
1、本土非酿酒酵母菌株纯种发酵动力学及对葡萄酒挥发性化合物的影响(一)
2、滇黄精水提物促进罗伊氏乳杆菌生长增殖和定植的作用机制(四)
