生长曲线测定法和菌落计数法确定YchJ对鼠伤寒沙门菌抗逆能力的影响——方法
2方法

2.2ychJ敲除菌株构建及验证
2.2.1ychJ敲除菌株的构建
使用表1中包含同源臂序列的引物JDychJF和JDychJR进行PCR扩增打靶区域,对PCR产物进行测序,确认gRNA打靶位点序列的正确性。将CRISPRB质粒电转入ATCC14028s感受态细胞,将线性打靶DNA片段电转化入ATCC14028sCRISPRB感受态细胞,选择测序正确的克隆,将CRISPRB质粒消去,获得敲除阳性克隆菌株ATCC14028sΔychJ.
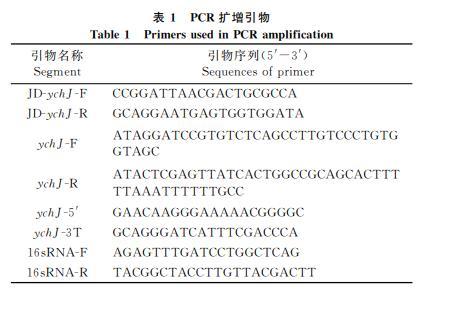
2.2.2ychJ敲除菌株的验证将过夜培养的WT及ΔychJ按1∶100转接于LB液体培养基中,在37℃、200r/min条件下培养至A600值约为0.5.以菌液为模板,使用表1中ychJF和ychJR为引物对两株菌进行基因扩增验证。其余菌液经5000r/min离心2min后弃上清,收集菌体。用RNA提取试剂盒提取细菌总RNA,然后使用反转录试剂盒将RNA反转录成cDNA.使用实时荧光定量PCR试剂盒加入ychJ基因特异引物ychJ5和ychJ3T进行实时定量PCR实验。内参选用16sRNA.引物序列如表1.
2.3生物膜形成能力检测
2.3.1刚果红染色法
配制刚果红培养基,配方为蛋白胨10mg/mL,酵母粉5mg/mL,琼脂粉7.5mg/mL,刚果红40μg/mL,121℃高压灭菌30min,获得刚果红平板。取2μL过夜培养的菌液轻轻点在刚果红平板上,37℃继续培养48h,观察细菌生物膜表型。2.3.2结晶紫半定量法将过夜培养的WT及ΔychJ菌株按1∶100转接于LB液体培养基中,在37℃、200r/min条件下培养至A600值约为0.5,随后再次按1∶100稀释于LB液体培养基中。将稀释后的菌液转接至96孔板中,30℃静置培养72h.测量每孔A600值后,弃去菌液。测量每孔A600值后,用PBS冲洗,加入甲醇固定20min,0.1%的结晶紫染色液,静置染色15min,最后加入乙酸溶液,溶解结晶紫染料。在570nm下测定每孔吸光度,A570/A600与生物膜生长量成正比。
2.4抗生素耐受性检测
2.4.1生长曲线测定法
将过夜培养的WT及ΔychJ菌株按1∶100转接于LB液体培养基中,在37℃、200r/min条件下培养至A600值约为0.5,随后再次按1∶100稀释于LB液体培养基中,加入终浓度为0.5μg/mL氨苄青霉素或0.1μg/mL诺氟沙星。在96孔生长曲线测定板中加入300μL/孔的菌液,随后将孔板放入生长曲线仪中进行A600值的测定。仪器参数设定:温度为37℃,测定波长为600nm,振荡频率为10s/min,间隔检测时间为5min,连续记录24h.

2.4.2菌落计数法
分别取生长曲线测定实验中培养5h(对数期)及12h(平台期)的菌液,用PBS进行10倍稀释,稀释后的菌液涂布于LB琼脂平板上,37℃静置培养过夜,再用微生物生长曲线监测系统计数平板中细菌数目。
2.5移动性检测
将过夜培养的WT及ΔychJ菌株按1∶100转接于LB液体培养基中,在37℃、200r/min条件下培养至A600值约为0.5.取1mL菌液3000r/min低速离心5min,弃上清后用20μLPBS重悬,吸取1μL重悬液滴在含0.25%琼脂的半固体培养基上,25℃培养24h,测量菌圈直径,以确定运动能力的差异。
相关新闻推荐
1、检测细菌菌落数,2,3,5-三苯基氯化四氮唑(TTC)浓度多少合适
