鸡印第安纳株沙门菌生长、致病性及药物敏感性研究(二)
1.4生长曲线测定
将分离的菌株接种到LB培养基中,于37℃摇床振荡培养,采用全自动微生物生长动态监测系统测定菌液600 nm的吸光值(OD600),当OD600值达到1时,将菌液按1∶100进行稀释后,接种到新鲜的LB培养基中120 r/min摇床培养,每隔1 h取出,测定OD600值,连续测16 h,绘制菌液吸光度曲线;分别在1、2、4、8、10、12、14、16 h吸取培养菌液,用LB肉汤进行10倍梯度稀释,并接种在LB平板上,37℃培养16 h,计数菌落,绘制活菌数变化曲线。
1.5毒力测定
将分离鉴定后的菌株接入LB液体培养基,37℃200 r/min培养12 h获得菌液。将菌液离心,收集菌体,使用生理盐水清洗菌体2次后备用。将30只3日龄SPF雏鸡随机分为5组,每组6只。第1~5组雏鸡肌肉注射菌液,接种剂量依次为1.50×107、1.50×106、1.50×105、1.50×104、1.50×103 CFU,对照组雏鸡接种等量生理盐水,观察7 d内雏鸡发病及死亡情况,并计算分离菌半数致死量(LD50)。在接种后第3天,对3只病死雏鸡和2只健康雏鸡进行解剖检查,观察组织器官病变情况。
1.6耐药性检测
取分离菌株接种于LB培养基,于37℃摇床振荡培养过夜。用无菌生理盐水将菌液稀释至0.5麦氏浊度标准。取灭菌棉签蘸取菌液均匀地涂布于MH琼脂平板。按WHO提供的Kindy-Bauer操作方法将药敏纸片贴在涂布细菌的MH琼脂平板上,37℃过夜培养,测量抑菌圈的直径,按照药敏纸片说明书进行药物敏感性判定。
1.7全基因组测序分析
分离菌株的全基因组测序委托上海凌恩生物科技有限公司完成,测序过程按照标准流程进行。提取高质量细菌DNA并进行质量检测,采用PacBio平台构建测序文库、文库质量检测和文库测序,使用Unicycler v0.4.8以默认参数进行基因组组装,并通过Circlator v1.5.5软件构建菌株完成图。细菌基因模型使用GeneMarkv4.17进行识别。将所有基因模型与NR、eggNOG、SwissProt、KEGG、COG数据库模块进行比对,完成基因功能注释。利用综合的抗生素抗性基因数据库CARD发掘分离株的耐药基因。采用毒力因子数据库VFDB比对菌株的毒力因子。使用SeqSero 1.2数据库对菌株进行血清型分析,PlasmidFinder 2.1分析质粒类型;采用IECfinder预测基因组的可移动元件。
1.8比较基因组学分析
以NCBI数据库中6株国内分离的鸡源印第安纳沙门菌基因组作为参考基因组,与测序获得的分离株SM24全基因序列进行比较分析,6株参考菌株的信息见表1。
采用序列比对软件MUMmer鉴定菌株的同源基因,并使用CD-HIT快速聚类分析对菌株基因组Core/Pan基因进行聚类,鉴定菌株共有和特有基因。利用MUSCLE软件进行菌株Core基因多序列比对,并使用PhyML软件中的最大似然法(ML法)构建菌株进化树。
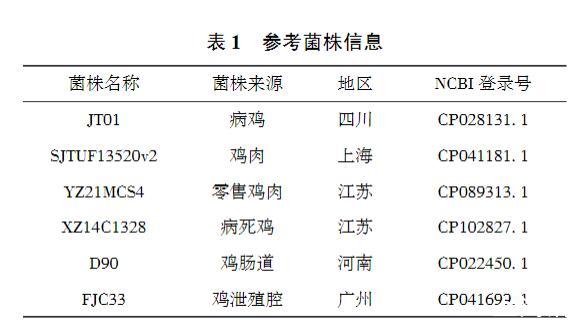
表1参考菌株信息
2结果与分析
2.1沙门菌分离与鉴定
发病鸡病料经PBW预增菌和MM培养基的选择性增菌,接种至XLT4选择性平板上,37℃培养24 h,其中1份样品培养出圆形、边缘整齐、呈灰白色,中心呈黑色、大小均一的单一菌落(图1A)。经革兰染色,该菌被染成红色,菌体呈短杆状(图1B),初步判定该菌为革兰阴性的沙门菌。提取细菌基因组,采用细菌通用16S rRNA引物进行扩增,获得大小为1 500 bp左右的PCR产物(图2),并对产物进行测序,将16S rRNA基因序列在NCBI数据库进行BLAST比对,其序列与沙门菌属的同源性均高·26·Animal Husbandry&Veterinary Medicine 2025 Vol.57 No.4于99%,因而确定分离菌株为沙门菌,命名为SM24株。
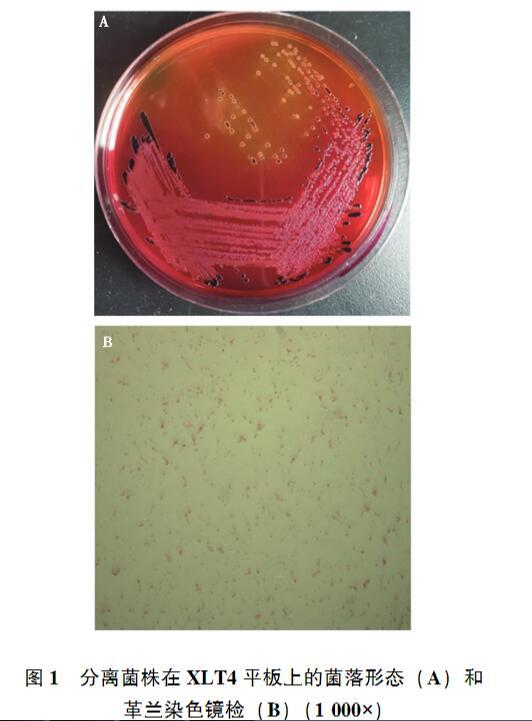
图1分离菌株在XLT4平板上的菌落形态(A)和革兰染色镜检(B)(1 000×)M.DL2000 DNA Marker;1、2.16S rRNA基因的PCR产物。
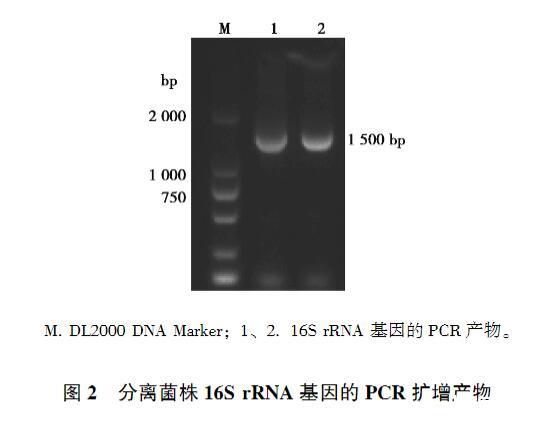
图2分离菌株16S rRNA基因的PCR扩增产物
相关新闻推荐
2、结核分枝杆菌药物敏感性试验:细菌计数仪VS磨菌瓶,哪个更好用
