鹌鹑肺炎克雷伯菌血清型鉴定、耐药性检测及致病潜力(二)
1.516SrDNA鉴定和遗传进化分析
使用细菌基因组DNA提取试剂盒提取纯培养菌株的全基因组,参考Colodner等方法使用16SrDNA通用引物27F(5‘-AGAGTTTGATC-MTGGCTCAG-3’)和1492R(5‘-GGTTACCTTG-TTACGACTT-3’)进行PCR扩增,PCR反应体系25μL:2×EasyTaqPCRSuperMix(+Dye)12.5μL,上、下游引物各0.6μL,DNA模板1.0μL,ddH2O10.3μL.PCR扩增程序:94℃预变性5min;94℃变性30s,54℃退火30s,72℃延伸30s,共35个循环;72℃延伸10min;4℃保存。PCR产物用1.0%琼脂糖凝胶电泳检测,并送至生工生物工程(上海)股份有限公司进行测序拼接,测序结果在NCBI中BLAST进行序列比对,使用Mega11.0软件构建系统进化树。
1.6肺炎克雷伯菌特异性
基因检测以提取的细菌DNA为模板,参考吴自豪等研究报道的引物(F1:5‘-CGATTCTGGAAATGG-CAAAAG-3’;R1:5‘-CGTGATCAGCGGTGACT-ATGAC-3’),对肠杆菌科特异性基因phoA进行PCR扩增,预期扩增产物大小为720bp.PCR反应体系及程序同1.5,其中退火温度为58℃。参考王乐等方法,使用特异性引物(F2:5‘-TGA-TTGCATTCGCCACTGG-3’;R2:5‘-GGTCAACC-CAACGATCCTG-3’)对肺炎克雷伯菌溶血菌素基因khe进行PCR扩增,预期扩增产物大小为498bp.PCR反应体系及程序同1.5,其中退火温度为56℃。PCR扩增产物用1.0%琼脂糖凝胶电泳检测。
1.7肺炎克雷伯菌荚膜血清型检测
参考解秀梅等研究合成肺炎克雷伯菌7种常见荚膜血清型引物,PCR反应体系及程序同1.5,退火温度见表1.PCR扩增产物通过1.0%琼脂糖凝胶电泳检测。
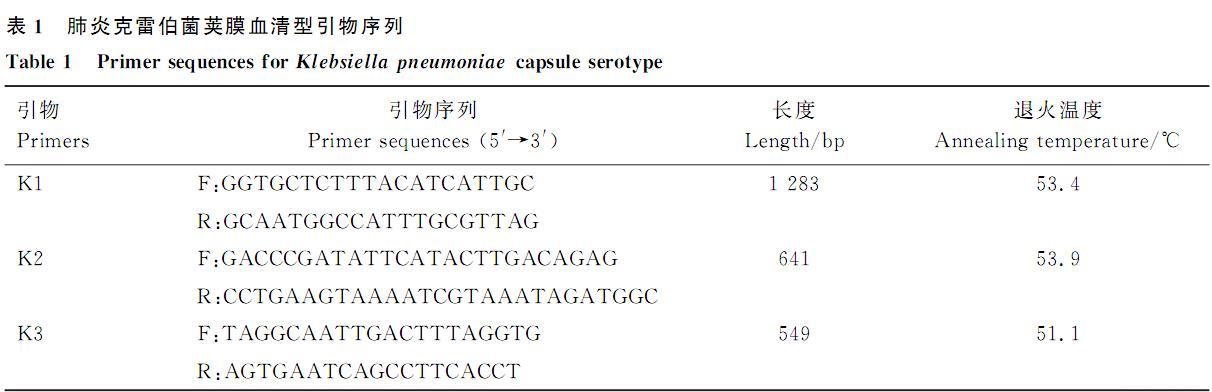

表1肺炎克雷伯菌荚膜血清型引物序列
1.8药物敏感性检测
使用K-B法检测分离菌株对β-内酰胺类、四环素类、氯霉素类、多肽类、氨基糖苷类、磺胺类、喹诺酮类以及大环内酯类等9大类24种常见抗菌药物的敏感性。用无菌涂布器将纯培养菌液均匀涂布于LB琼脂培养基,并在 oCelloScope 中于 37°C 下培养(无需摇动)。每 30分钟至 10 小时采集一次图像。每个样品一式三份进行分析,并计算平均值和标准差。
1.9耐药基因检测
参考文献合成肺炎克雷伯菌5大类11种耐药基因引物,PCR反应体系及程序同1.5,退火温度见表2.PCR扩增产物进行1.0%琼脂糖凝胶电泳检测。

表2耐药基因引物序列
1.10毒力基因检测参考文献合成肺炎克雷伯菌18种毒力基因特异性引物,利用PCR扩增检测分离株携带毒力基因情况。PCR反应体系及程序同1.5,退火温度见表3,PCR产物进行1.0%琼脂糖凝胶电泳检测。
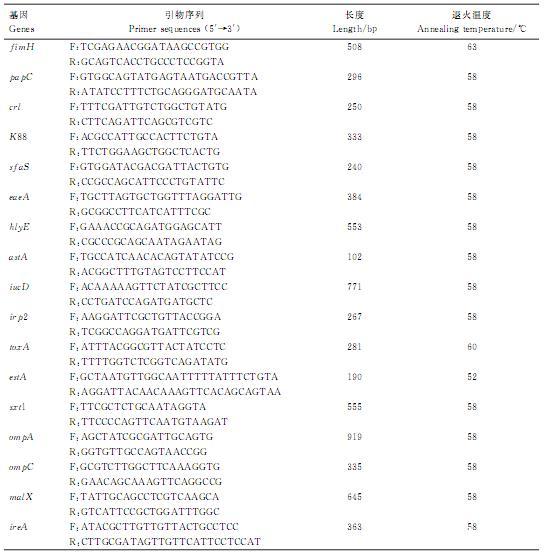
表3毒力基因引物序列
1.11生物学特性分析
1.11.1生长曲线测定
实验中,将过夜培养的细菌稀释至初始细胞密度为104CFU/mL,然后将不同浓度的XO和LPO添加到96孔板中,每种条件设置三份重复。oCelloScope被放置在37°C、5%CO₂的培养箱中,每隔15分钟对每个孔进行两次扫描,持续监测24小时。通过背景校正的吸收算法,生成细菌生长曲线,并计算每个时间点的平均增长量。以接种时间为横轴、D600nm值为纵轴绘制细菌生长曲线。
1.11.2酸碱耐受性测定
取150μL纯培养菌液分别接种于5mLpH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的LB肉汤培养基,于37℃、180r/min摇床孵育24h,使用丹麦Biosense微生物动态曲线监测系统测定菌液D600nm值,试验设置3个重复,取平均值,利用Origin2024软件作图,以pH为横轴、D600nm值为纵轴绘制pH稳定曲线。
1.11.3接种量测定
分别向5mLLB肉汤培养基中加入50、100、150、200、250μL纯培养菌液,使接种量依次达到培养基体积的1%、2%、3%、4%、5%,于37℃、180r/min摇床孵育12h,使用丹麦Biosense微生物动态曲线监测系统测定菌液D600nm值,试验设置3个重复,取平均值,利用Origin2024软件作图,以接种量为横轴、D600nm值为纵轴绘制接种曲线。
1.12致病性试验
将分离菌接种于LB液体培养基中,并于最适条件下培养,随后进行平板计数,并计算其菌液浓度,按照测定结果,将菌液稀释成不同浓度(1×105、1×106、1×107、1×108、1×109CFU/mL)。将120只小鼠分为12组,其中2组为对照组,其余10组为不同浓度菌株处理组(每株菌5个浓度组),每组10只小鼠。对照组小鼠注射0.5mL生理盐水,其他各组小鼠分别注射不同浓度菌液(0.5mL/只)。攻毒12h后开始观察,记录1周内小鼠发病和死亡情况,用寇氏改良法计算分离菌株对小鼠的半数致死量(LD50)。
相关新闻推荐
1、基于全细胞生长的 GAT 生长耦合策略,突破合成肌酸过程中的代谢瓶颈
