生食大眼金枪鱼中生物胺产生菌分离纯化、菌落总数、生长曲线及形状鉴定(二)
1.3.4菌株的分离纯化
参考吴燕燕等的方法,无菌条件下取0℃贮藏12 d的5 g鱼肉于45 mL无菌生理盐水中,制备为10-1样液,依次梯度稀释到10-2、10-3、10-4和10-5后,各取100μL菌液涂布到生物胺初筛培养基上,30℃培养3 d。
挑取蓝紫色菌落在TSA培养基上划线培养至出现单菌落,30℃培养3 d。
将单菌落划线接种于TSA斜面培养基上富集培养,并于菌种保藏箱中临时保藏。
1.3.5生长曲线的测定
参考AYYASH等的方法,将分离纯化的菌落接种于TSB培养基中活化培养,每间隔相同时间用Biosense自动生长曲线分析系统连续测定培养液的OD605nm值,观察菌株的生长情况。
1.3.6生物胺质量分数的测定
参考赵庆志等的衍生方法略有改动,将单菌落接种于TSB培养基中活化培养,30℃培养3 d,各取1 mL活化菌液离心,取上清液,对上清液进行衍生处理。
色谱条件参考GB5009.208—2016的方法。色谱柱:WondaCract ODS-2色谱柱(4.6 mm×250 mm,5μm),柱温40℃,流速0.8 mL/min,进样量10μL,检测波长254 nm。流动相A为含1%甲酸的0.01 mol/L乙酸铵溶液,流动相B为乙腈,梯度洗脱程序为:0~22 min,B=58%(体积分数);22~25 min,B=78%(体积分数);25~32.01 min,B=90%(体积分数);32.01~37 min,B=58%(体积分数),外标法定量。标准曲线回归方程如表1所示。
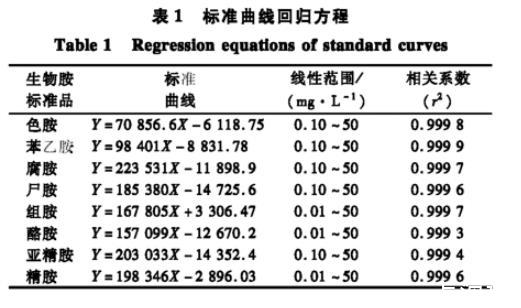
表1标准曲线回归方程
1.3.7形态学指标
观察并记录TSA上单菌落形态特征,挑取单菌落进行涂片、革兰氏染色,于显微镜下观察并记录其大小、颜色、形状、排列等。
1.3.8菌种鉴定
1.3.8.1生理生化实验鉴定
吸取适量的菌液分别与3 mL 0.45%(质量分数)NaCl生理盐水混匀,配制相当于0.50~0.63麦氏单位的菌悬液,使用VITEK 2全自动微生物分析系统进行菌种鉴定。
1.3.8.2产生物胺细菌的16S rDNA鉴定
筛选出产胺量最高的菌株进行DNA提取,将PCR扩增产物进行凝胶电泳分析,送与测序公司进行测序,将返回的序列进行比对。
2结果与分析
2.1菌落总数和K值测定结果
将大眼金枪鱼生鱼片置于0℃下贮藏,结果如图1所示。鱼肉中菌落总数的变化情况由图1-a可知,大眼金枪鱼初始菌落总数为2.46 lgCFU/g,菌落总数初期生长缓慢,第4天达到4.45 lgCFU/g,超过生食金枪鱼SC/T 3117—2006规定标准,第12天时菌落总数为7.13 lgCFU/g,之后菌落长势趋于平缓。K值是反映水产品鲜度的一个重要指标,可以明确表明鱼肉的新鲜程度。一般认为,K值低于20%为一级鲜度,20%~40%为二级鲜度,大于70%已为腐败。由图1-b可知,鱼肉初始K值为12.1%,第4天超过20%,不能用于制作生鱼片,K值增长速度为3.30%/d。为更加准确分离出生物胺产生菌,该实验选择菌落总数达到相对稳定阶段12 d的鱼肉作为实验样品。
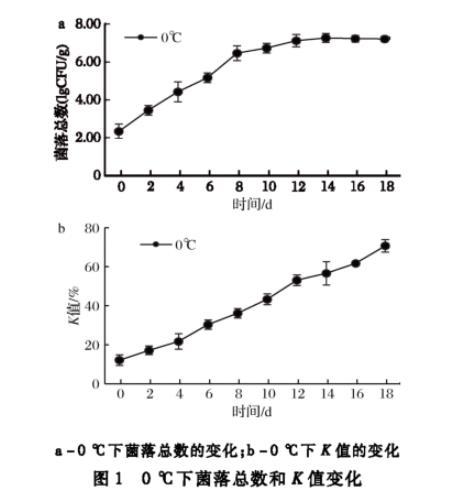
a-0℃下菌落总数的变化;b-0℃下K值的变化图1 0℃下菌落总数和K值变化
2.2生物胺产生菌的分离纯化
典型的产胺菌在生物胺筛选培养基中显示蓝紫色,其原理是微生物利用培养基中的游离氨基酸生成了碱性生物胺,从而使菌落周围环境的pH值上升,溴甲酚紫指示剂显示为蓝紫色。挑取蓝紫色菌落划线接种于TSA培养基上纯化培养,最终得到9株单菌落,编号为B-1~B-9。
2.3生物胺产生菌的生长曲线
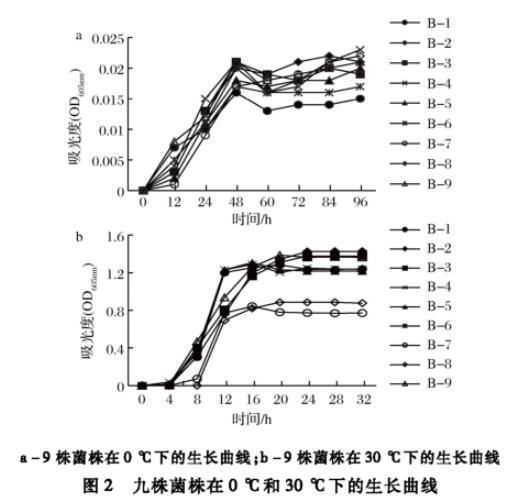
将9株生物胺产生菌分别接种于TSB培养基中,确定9株细菌在0和30℃条件下的生长曲线,结果如图2所示。9株菌株在0℃下生长缓慢,48 h后进入生长稳定期。而在30℃下培养9株菌,对数生长期为4~12 h,之后进入生长稳定期。结果表明,从大眼金枪鱼中分离得到的9株菌株适宜在较高温度下生长,初步鉴定为嗜温菌(25~40℃)。
相关新闻推荐
1、RIP 衍生物对耐甲氧西林金黄色葡萄球菌生长曲线及生物膜形成的影响(二)
