低纤维饮食与pks+大肠杆菌的协同致癌(CRC)作用
结直肠癌(CRC)是全球第三大高发癌症,其发生涉及饮食、肠道微生物群、炎症和遗传因素的复杂交互。2025年3月,加拿大多伦多大学Alberto Martin团队在《自然·微生物学》发表研究,首次系统揭示低纤维饮食如何通过调控PPAR-γ信号、硝酸盐代谢和pks+大肠杆菌定植,驱动CRC发生。这项研究为基于饮食干预的CRC防治提供了新靶点。
一、低纤维饮食与pks+大肠杆菌的协同致癌作用
研究采用Il10-/-小鼠模型(易发肠道炎症),分别给予正常饮食(NCD)、低碳水化合物饮食(LC)和西方高脂高糖饮食(WSD),并定植三种CRC相关菌(pks+大肠杆菌NC101、ETBF、肝螺杆菌)。
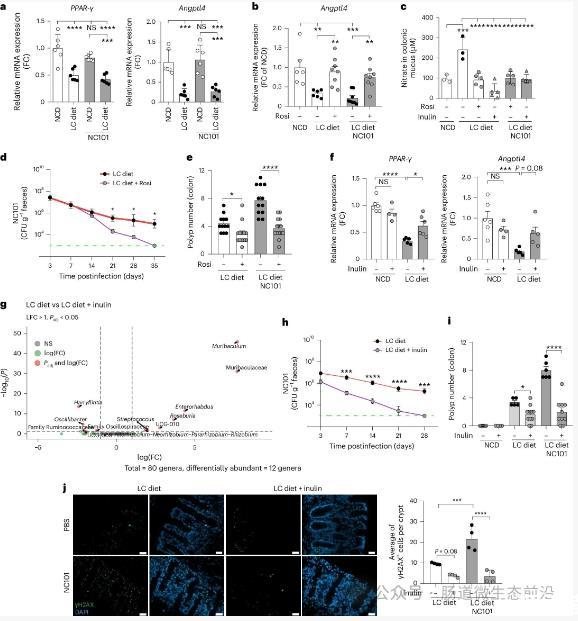
结果发现,仅LC饮食组中,pks+大肠杆菌定植显著增加结肠息肉数量和中高度不典型腺瘤。而缺失colibactin毒素的NC101ΔclbP菌株无此效应。在野生型小鼠中,LC饮食与NC101同样协同促进息肉形成。
长期LC饮食(感染前预喂4周)进一步加剧肿瘤负荷,表明纤维缺乏与细菌基因毒性存在持续互作。值得注意的是,WSD虽诱导肥胖,但未显著增强NC101的致癌性,提示碳水化合物不足(而非高脂高糖)是关键风险因素。
二、纤维缺乏如何重塑肠道微环境助长致癌菌
1.物理屏障破坏与菌群定植
LC饮食小鼠结肠粘液层厚度显著降低,粘蛋白基因Muc2转录下降,导致pks+大肠杆菌更易贴近上皮。同时,肠道菌群中肠杆菌科(含大肠杆菌)丰度上升,而具有抗炎作用的双歧杆菌、Turicibacter等菌属减少。
2.炎症与硝酸盐的恶性循环
LC饮食诱发慢性黏膜炎症,中性粒细胞和Th17细胞浸润增加,促炎因子IL-6、IL-17、IL-22高表达。炎症激活诱导型一氧化氮合酶(iNOS),导致肠腔硝酸盐水平升高。
大肠杆菌可利用硝酸盐作为电子受体,通过硝酸还原酶促进自身生长。实验显示,野生型大肠杆菌在LC饮食小鼠中的竞争性定植能力比硝酸盐代谢缺陷菌株高25倍。使用iNOS抑制剂L-Nil可逆转硝酸盐水平上升和NC101定植。
三、PPAR-γ信号通路的核心桥梁作用
LC饮食抑制结肠PPAR-γ及其下游因子Angptl4的表达。PPAR-γ是调控炎症和代谢的关键核受体,其激活可抑制iNOS表达。
研究通过两种干预验证其功能:
•给LC饮食小鼠补充PPAR-γ激动剂罗格列酮,可恢复Angptl4表达,降低硝酸盐水平和炎症因子,减少NC101定植和肿瘤。
•补充可发酵纤维菊粉,同样激活PPAR-γ信号,增加短链脂肪酸产生菌(如Muribaculum、Roseburia)丰度,逆转LC饮食的致癌效应。
四、遗传易感性与细菌毒素的叠加效应
在错配修复缺陷(Msh2-/-)小鼠中,pks+大肠杆菌定植诱导更严重的DNA损伤(γH2AX+细胞增多)和细胞衰老(SA-β-gal活性升高),并通过衰老相关分泌表型(SASP)促进肿瘤。抗衰老剂非瑟酮可抑制息肉形成。
此外,在Msh2-/-小鼠中,DSS(化学性结肠炎诱导剂)或LC饮食均与NC101协同增加肿瘤数,证实炎症是遗传缺陷背景下细菌致癌的“加速器”。
五、临床启示与转化价值
该研究揭示了“低纤维饮食→PPAR-γ抑制→iNOS/硝酸盐上调→pks+大肠杆菌扩增→DNA损伤”的因果链条,解释了高纤维饮食为何能降低CRC风险。
针对高危人群(如炎症性肠病患者或MMR基因突变携带者),补充可发酵纤维或PPAR-γ激动剂可能成为有效的预防策略。同时,监测肠道pks+大肠杆菌载量及硝酸盐代谢水平,或可为CRC早期预警提供新标志物。
结论
这项研究将饮食成分、微生物功能、宿主信号通路和遗传背景整合为统一的CRC发病模型,突出了膳食纤维通过PPAR-γ-硝酸盐轴调控致癌菌稳态的核心作用。未来需探索纤维类型(如果胶、菊粉、纤维素)的差异效应,以及如何在个体化营养干预中精准调控肠道微环境。
参考文献
Nature Microbiology(2025).doi:10.1038/s41564-025-01938-4
相关新闻推荐
1、快速药物敏感性检测:荧光素酶生物发光法与微量肉汤稀释法的对比分析(三)
