内酯型槐糖脂对白色念珠菌生长抑制和生物膜形成的影响(三)
3.4、LSL对白色念珠菌细胞膜通透性和完整性的影响
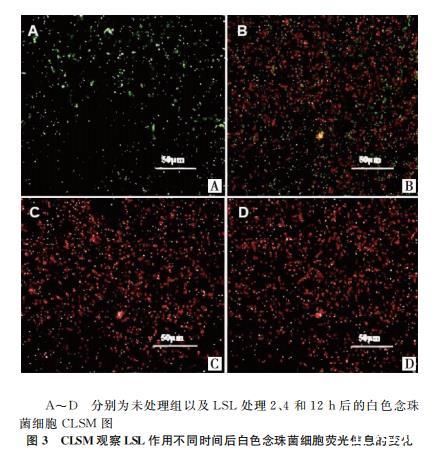
使用CLSM进一步观察和评估LSL对白色念珠菌细胞膜完整性和通透性的影响。细胞膜完整的白色念珠菌细胞染色后呈绿色荧光,细胞膜受损后染色呈红色荧光。图3展示了未处理组和LSL处理2、4、12 h后白色念珠菌细胞膜完整性的变化。可以发现,未处理的细胞呈明亮的绿色荧光,表明真菌细胞膜完整性良好(图3A),而LSL处理后,红绿荧光比率随时间延长呈非线性增加,处理4h后视野中基本均为红色荧光,表明真菌细胞膜的完整性被LSL逐步破坏(图3B-D)。由此可知,LSL能够通过改变白色念珠菌细胞膜的通透性,破坏细胞膜的完整性,使其无法维持正常的生命活动实现抑菌和杀菌目的。
3.5、LSL对白色念珠菌胞内ATP含量的影响
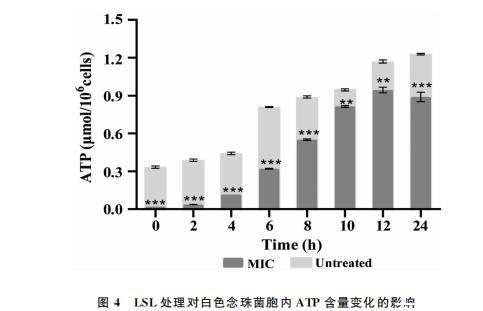
通过测定胞内ATP含量的变化考察LSL对白色念珠菌能量代谢的影响。如图4所示,在整个培养过程中,LSL处理组的ATP含量始终显著低于对照组(P<0.05),提示处理组细胞ATP的合成一直处于被抑制状态。其中,0~2h内两者差距倍数最大,这可能与作用初期部分白色念珠菌细胞壁完整性和细胞膜通透性的改变导致的胞内ATP的快速流失有关。随着培养时间的延长,未处理组胞内ATP含量呈持续增加趋势,LSL处理组胞内ATP含量呈先增大后减小趋势,均与其生长曲线保持一致。可以推断,在处理浓度为MIC的LSL作用下,虽然白色念珠菌细胞的能量代谢被抑制,细胞供能不足,影响了细胞的生理代谢,导致了部分细胞生长停滞甚至死亡,但仍有大量细胞存活,这一结果与上述显微镜观察结果一致。
3.6、LSL对白色念珠菌胞外紫外吸收物质浓度的影响
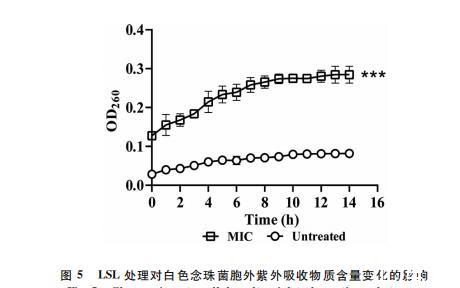
通过测定LSL对白色念珠菌胞外核酸和蛋白质等紫外吸收物质含量的影响,进一步确定其对细胞膜的破坏作用。如图5所示,在整个培养过程中,LSL处理组的OD260在每个时间点均显著高于未处理对照组(P<0.05)。LSL处理组胞外紫外吸收物质含量随培养时间延长持续增长,与此同时,未处理对照组胞外紫外吸收物质则一直保持较低水平,且两者的差距随时间的延长逐渐扩大。上述结果进一步表明,LSL破坏了白色念珠菌细胞膜的完整性,导致胞内的蛋白质、核酸等物质外流,而正常培养条件下,细胞膜完整程度高,胞内物质流出比例较低。
3.7、LSL对白色念珠菌生物膜形成的影响
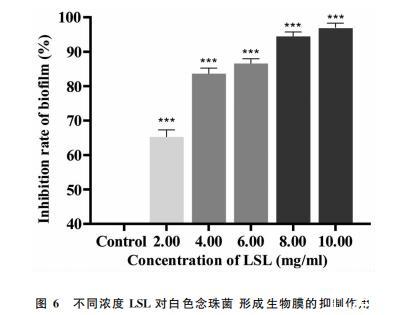
在微孔板中培养生物膜,使用结晶紫染色法考察LSL对白色念珠菌生物膜形成的影响,结果如图6所示。与对照组相比,不同浓度LSL处理后,最终白色念珠菌生物膜形成量减少了65.2%~97.0%,说明低浓度的LSL即可有效抑制白色念珠菌生物膜的形成(P<0.05)。此外,LSL对生物膜形成的破坏作用与其剂量呈正相关,LSL浓度越高,抑制效果越强。在MIC浓度的LSL作用下,生物膜的形成下降了86.6%,这可能还与LSL导致白色念珠菌细胞受损或不能生存,无法形成生物膜有关。
4、讨论
生物表面活性剂一直被认为是可用于环境和生物医学相关领域的,具有潜在应用价值的物质。近年来,生物表面活性剂在医疗保健相关中的应用受到越来越多的关注,大量研究表明,生物表面活性剂具有广泛的抗菌和抗黏附活性,其主要通过防止微生物黏附在固体表面来抑制、控制或破坏生物膜的形成。
SLs是一类最具应用潜力的生物表面活性剂,已表现出优秀的表面活性剂和广泛的抗菌活性。在抗细菌方面,Kim等研究发现,30μg/mL的SLs可以抑制大肠埃希菌的生长,但Ma等的研究发现,LSL对金黄色葡萄球菌以及铜绿假单胞菌均有显著的生长抑制效应,MIC值分别为0.05mg/mL和4.00 mg/mL,但对大肠埃希菌和乳杆菌的抑制作用较差。Lydon等报道20 mg/mL的ASL对粪肠球菌和铜绿假单胞菌具有抗菌作用,但大多数报道认为ASL不具备抑菌活性。在抗细菌生物膜形成方面,Diaz De Rienzo等研究发现,5%的SL能够破坏枯草芽孢杆菌和金黄色葡萄球菌的单菌培养和混合培养形成的生物膜。Seena等的研究发现,基于ASL和抗菌肽的制剂可以用作金黄色葡萄球菌和大肠埃希菌抗菌剂和抗菌生物膜剂。在抗真菌方面,SLs被报道能够抑制植物源致病真菌水稻纹枯菌、水稻稻瘟菌和马铃薯晚疫病菌孢子的萌发以及菌丝的生长。LSL还被报道具有抑制红色毛癣菌、犬小孢子菌、马拉色菌等皮肤致病性真菌生长和菌丝蔓延的作用。
机会性致病真菌白色念珠菌是真菌相关院内感染的主要原因之一,其感染范围从浅表到全身。当外界环境或人体免疫系统发生改变时,白色念珠菌可以快速增殖并形成生物膜,侵袭机体细胞、组织,造成黏膜和真皮感染。临床研究表明,白色念珠菌等微生物可以以生物膜的形式黏附于创口或者医疗器械表面,引起机体的持续性感染。
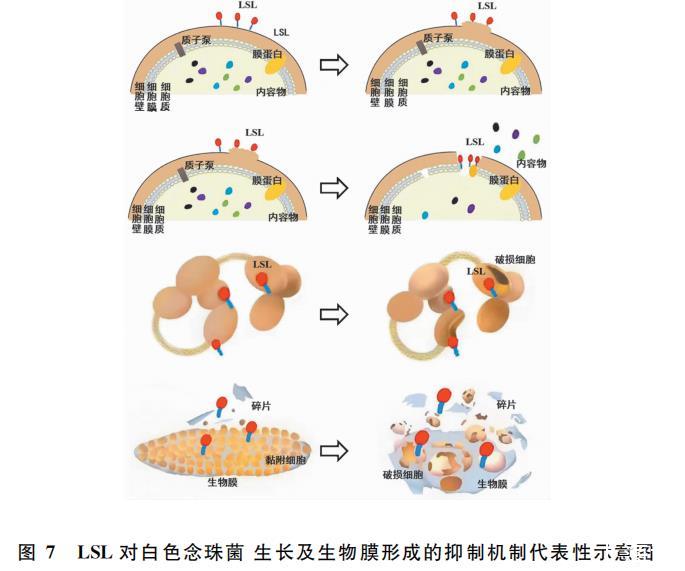
目前已有少量有关SLs对白色念珠菌浮游细胞的抗真菌活性及生物膜活性的报道。如Dengle-Pulate等研究表明,以月桂醇为底物制备的SLs有抗白色念珠菌浮游细胞生长作用,5.00mg/mL的SLs的抑制率为30%;细胞微观形态观察发现未处理组细胞膜和细胞内含物完整,处理组出现细胞质体积增加等现象。Haque等的研究发现,浓度为0.48 mg/mL的LSL即可抑制80%的白色念珠菌生物膜的形成,并降低预制生物膜的活力;且LSL与两性霉素B或氟康唑的联用对破坏生物膜的形成和预形成的生物膜有协同作用。
虽然上述文献以及前期实验室研究已确定了SLs的抗菌活性及抗生物膜作用,但同时也发现,SLs的结构和来源,被处理菌株的细胞形态、SLs的浓度及作用时间等的不同均会影响SLs的抑菌效果,给SLs的临床应用带来困扰。基于此,本研究以白色念珠菌浮游细胞和生物膜为研究对象,从浓度和作用时间两个维度,系统评价和探讨LSL对其生长和生物膜形成的抑制作用和抑制机制,评估LSL在抗菌药物开发中的潜在用途,为临床治疗白色念珠菌引起的相关疾病提供参考。
在本研究中,LSL对白色念珠菌的MIC和MFC分别为6.00mg/mL和18.00mg/mL,提示LSL对白色念珠菌的抑制效果优于已报道的以月桂醇为底物制备所得SLs的抗白色念珠菌活性。LSL对白色念珠菌的时间-抑菌曲线显示,LSL对白色念珠菌的动态抑制效果显著且快速,所有处理组在2h内基本均可达到最大抑菌率,且抑制作用具有长效性。生物膜形成抑制实验结果显示,LSL可以显著抑制白色念珠菌生物膜的形成,生物膜抑制率与其剂量呈非线性正相关;2.00 mg/mL的LSL即可抑制65.2%的白色念珠菌生物膜的形成,当LSL浓度为MIC时,生物膜形成量下降了86.6%,这一结果与上述Haque等所报道的0.48 mg/mL的LSL即可抑制80%的白色念珠菌生物膜的形成差异较大。
目前常用抗真菌药物的抑菌作用主要与其对真菌细胞壁、细胞膜、胞内外酶活性和能量代谢的影响等有关。本实验通过SEM观察菌体超微形态,CLSM检测处理前后细胞膜通透性变化,测定胞内ATP和胞外紫外吸收物质含量发现:
1.LSL处理后的白色念珠菌细胞表面形态和内部结构均发生改变,菌体细胞壁表面出现凹陷、皱缩和塌陷现象,部分菌体细胞壁及细胞膜被连续性破坏并出现“爆破”现象;
2.LSL处理后的CLSM视野基本均为红色荧光,提示白色念珠菌细胞膜的通透性发生改变,完整性被破坏,细胞逐步死亡;
3.LSL处理后的白色念珠菌胞内ATP含量显著降低,胞外紫外吸收物质含量显著升高,提示菌体胞内小分子及紫外吸收大分子物质发生泄漏。
由此推测,LSL可能通过以下机制发挥抑菌作用:
1.双亲性分子LSL具备的大环内酯结构通过改变白色念珠菌菌体细胞膜的通透性,使更多的LSL穿过细胞壁和细胞膜进入到细胞内,之后与细胞内参与合成细胞壁的物质发生特异性结合,进而影响菌体细胞壁的合成;
2.LSL进入细胞壁后,通过与细胞膜的磷脂层相互作用形成孔洞进一步破坏细胞膜的结构完整性;
3.细胞膜通透性和完整性发生改变,使细胞内物质如小分子物质、离子、ATP、核酸、蛋白质等发生外泄,影响菌体细胞正常新陈代谢系统;
4.细胞壁、细胞膜等细胞器的破坏干扰了细胞内蛋白质及遗传物质的合成与表达,使细胞不能合成正常的蛋白质,从而引起细胞物质、能量和信息的传递中断,最终导致细胞死亡。
研究已确定白色念珠菌在形成生物膜后对抗真菌药物的耐受性会大幅提高,生物膜抗药能力的增强与影响细胞初始黏附过程、形成微菌落、细胞外基质阻止药物渗透等多种因素有关。本研究结果表明,低于MIC的亚抑制浓度的LSL即可以有效阻止初始细胞在非生物表面上的附着,进而减少白色念珠菌形成生物膜的数量。此外,LSL诱导的白色念珠菌细胞受损或死亡也使白色念珠菌无法形成成熟的生物膜。因此,抑制初始细胞的黏附和诱导细胞受损并脱离可能是对抗生物膜相关感染的有效策略。
结论
综上所述,LSL能够有效抑制白色念珠菌浮游细胞的生长和生物膜的形成,这种作用主要通过影响细胞壁的合成,提高细胞膜的通透性,破坏细胞膜的完整性,引起胞内ATP、核酸、蛋白质等物质外泄,以及有效阻止初始细胞的黏附和诱导生物膜的分散和脱离实现。上述研究结果可为开发基于LSL的抗真菌制剂或佐剂,用于治疗由白色念珠菌引起的真菌感染提供一定的参考和借鉴。然而,LSL作用后白色念珠菌细胞在分子层面上发生的结构和功能变化,以及细胞的信号传导及遗传信息表达是否受到干扰等相关的研究尚不明确,仍需进一步探究和验证。
相关新闻推荐
2、脓肿分枝杆菌胞内菌落计数、对RAW264.7细胞血红素氧化酶1调控自噬影响(一)
3、苯乳酸对霍氏肠杆菌生长曲线、细胞凋亡、抑制活性、DNA的影响(三)
