从菌丝到细胞:切叶蚁共生真菌原生质体的可控制备与高精度评估(二)
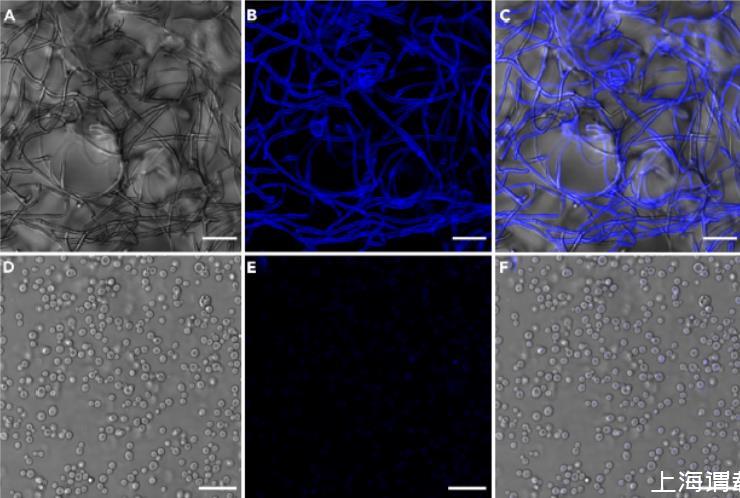
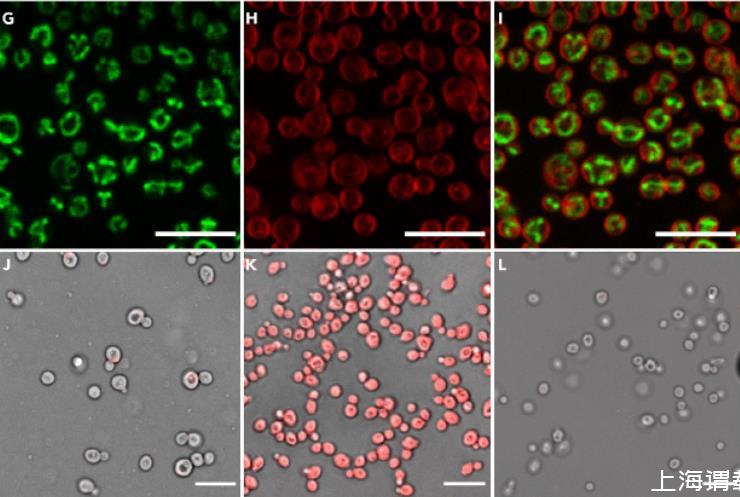
图2、代表性的显微镜图像展示了龙胆属菌(L.gongylophorus)原生质体的成功分离、细胞壁的去除以及存活情况的评估。原生质体的形态与完整性验证。(A)Calcofluor White染色显示细胞壁完全缺失(无蓝色荧光信号),表明成功去除细胞壁;(B)FM4-64荧光染料标记清晰的质膜轮廓,证实膜结构完整;(C)SYTO 18染色显示线粒体呈绿色荧光,表明细胞器保持活性;(D)相差显微镜下观察到典型的球形、透亮原生质体,无明显破裂或碎片。
(E)对分离出的原生质体进行CFW染色,结果显示细胞壁未产生荧光。(F)明场图像与CFW光学通道的叠加图像证实了细胞壁的完全去除。(G)使用Syto18染色揭示了活原生质体内的线粒体分布情况。(H)使用FM4-64染色观察了相同原生质体的质膜。(I)Syto18和FM4-64光学通道的叠加图像突出了线粒体和膜的明显定位差异。(J)使用台盼蓝染色对分离出的原生质体进行活力评估(活原生质体会不吸收该染料)。(K)固定原生质体的阳性对照(4%甲醛溶液)显示了均匀的台盼蓝吸收情况。(L)未染色的原生质体在渗透缓冲液中成像被用作阴性对照,以确认该染料具有特异性结合能力。
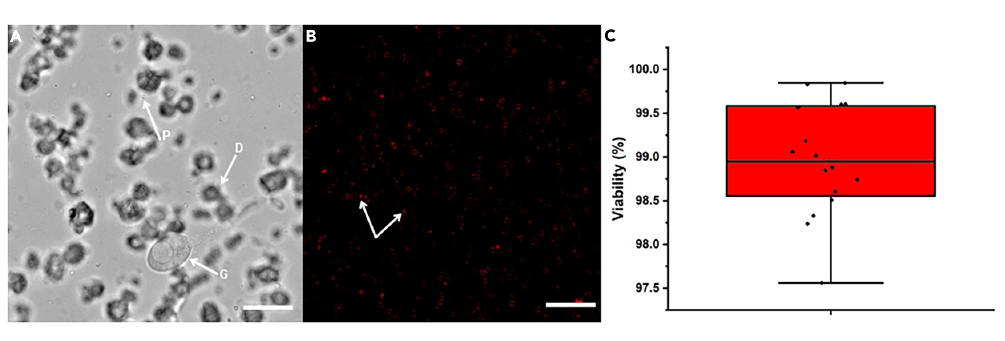
图3、监测白菇属菌丝体原生质体的酶消化过程及存活情况.(A)时间进程下的光学显微镜图像,显示在6小时间隔内进行酶消化过程中的白菇属菌丝体。箭头指示出新生的原生质体(P)、在细胞壁降解过程中产生的菌丝碎片(D)以及部分消化的菌核(G)。(B)分离出的原生质体的台盼蓝排除试验。箭头指示出已吸收染料的非存活原生质体,而存活的原生质体则排斥染料,并保留清晰的细胞质,染料仅限于细胞膜表面。(C)总结原生质体存活情况的箱线图,涵盖了15个独立的显微镜视野(每个250微米²视野的平均573个原生质体)。中心线表示平均存活率,外延代表标准偏差,每个数据点反映来自每个的测量值。
总结
本研究由哥本哈根大学的Ayoub Stelate与Jonathan Z.Shik合作完成,首次建立了一套高效、可重复的原生质体制备方案,专门针对切叶蚁共生真菌——Leucoagaricus gongylophorus。该真菌是切叶蚁农业系统中不可或缺的“作物”,但因其非模式生物特性及复杂的细胞壁结构(富含几丁质和葡聚糖),长期以来缺乏适用于其细胞操作的实验技术,严重制约了对其共生机制和生物学功能的深入研究。为突破这一瓶颈,作者开发了一种定制化的酶解体系,包含来自链霉菌的几丁酶、木霉的纤维素酶、担子菌的Driselase以及β-葡萄糖醛酸酶,并在1.2 M甘露醇或山梨醇的高渗缓冲液中进行消化,以平衡细胞壁降解效率与原生质体的渗透稳定性。该方案从培养三周的活跃菌丝体出发,通过优化酶浓度、pH(6.0)、温度(25°C)和振荡条件,成功释放出大量球形、无细胞壁的原生质体。
随后,采用40微米尼龙网过滤和低速离心(100×g)对原生质体进行温和纯化,最大限度地维持其完整性。为验证制备效果,研究团队运用多种荧光染色技术进行了全面的质量控制。Calcofluor White染色证实了细胞壁的完全去除。FM4-64和SYTO 18染色分别清晰地标记了完整的质膜和具有活性的线粒体;而台盼蓝(Trypan Blue)排斥实验则显示,所得原生质体的平均存活率高达98%。定量分析表明,每2毫克湿重的菌丝组织可产生约5.9–6.7亿个原生质体,产量足以支持后续的遗传转化、单细胞分析等下游应用。
此方法的成功建立,不仅为研究L.gongylophorus的细胞生物学、基因功能及与切叶蚁间的营养交换机制提供了关键工具,也为其他难以处理的非模式担子菌的原生质体制备提供了可借鉴的范式,极大地拓展了相关领域的实验手段。Ocelloscope是一种高通量、无标记的活细胞成像与分析系统,被用于实时监测和定量评估原生质体的形态完整性、浓度及活力状态。Ocelloscope在本研究中不仅作为高通量原生质体质量控制的核心设备,还为建立标准化、可推广的真菌原生质体制备流程提供了客观、定量的技术支撑,是连接方法开发与下游应用(如转化、单细胞分析)的重要桥梁。
相关新闻推荐
2、忍冬提取液对酸土脂环酸芽孢杆菌生长曲线、细胞形态和生物膜形成能力的影响(四)
